题目内容
15.下列判断正确的是( )| A. | Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2+4H+═SO42-+3S↓+2H2O | |
| B. | 用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)═TiO2•xH2O↓+4HCl | |
| C. | 滴加甲基橙试液后呈红色的溶液中可以大量共存:Na+、CO32-、K+、Al3+ | |
| D. | 25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
分析 A.发生氧化还原反应生成S、二氧化硫、硫酸钠和水;
B.发生水解反应生成TiO2•xH2O;
C.滴加甲基橙试液后呈红色的溶液,显酸性;
D.溶液体积未知,不能利用n=cV计算.
解答 解:A.Na2S2O3溶液中加入稀硫酸的离子方程式为S2O32-+2H+═SO2↑+S↓+H2O,故A错误;
B.用TiCl4制备TiO2的反应,为水解反应,可表示为:TiCl4+(x+2)H2O(过量)═TiO2•xH2O↓+4HCl,故B正确;
C.滴加甲基橙试液后呈红色的溶液,显酸性,则不能大量存在CO32-,且CO32-、Al3+相互促进水解,不能大量共存,故C错误;
D.溶液体积未知,不能利用n=cV计算,则不能计算OH-的数目,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断及离子共存,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关于有机物性质的说法正确的是( )
| A. | 乙酸乙酯和油脂均能发生水解反应生成醇 | |
| B. | 丙烯与氯气只能发生加成反应 | |
| C. | 溴乙烷与氢氧化钠的水溶液可反应生成乙烯 | |
| D. | 苯可以使酸性KMnO4溶液褪色 |
6.将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4,下列关于NaHSO4的说法中正确( )
| A. | NaHSO4固体熔化时破坏的是离子键和共价键 | |
| B. | NaHSO4固体中阳离子和阴离子的个数比是2:1 | |
| C. | NaHSO4固体溶于水时既破坏离子键又破坏共价键 | |
| D. | 因为NaHSO4是离子化合物,因此能够导电 |
3.可以把乙醇、乙酸、乙醛溶液区别开的一种试剂是( )
| A. | 银氨溶液 | B. | 新制Cu(OH)2悬浊液 | C. | 酸性KMn04溶液 | D. | 稀溴水 |
10.化学是人类利用自然资源、丰富物质世界的重要科学依据.下列说法不正确的是( )
| A. | 我国许多城市已经推广使用清洁燃料以减少环境污染,如压缩天然气(CNG)、液化石油气(LPG),这两类燃料的主要成分均是烃类 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 当今,实现煤的综合利用的主要途径是通过煤的干馏、煤气化和煤液化而获得洁净的燃料和多种化工原料 | |
| D. | 工业上利用金属活泼性不同,采用不同的冶炼方法冶炼金属,如电解法冶炼铝、热还原法冶炼铁、热分解法冶炼铜 |
20.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3,H2,C4H10? | B. | PCl3,CO2,H2SO4 | C. | SO2,SiO2,P2O5? | D. | CCl4,Na2S,H2O2 |
7.下列图示实验正确的是( )
| A. | 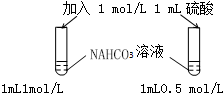 探究浓度对化学反应速率的影响 | B. | 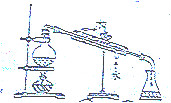 分离乙醇和乙酸的混合溶液 | ||
| C. | 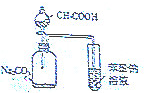 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 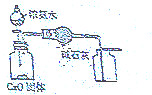 制取并且收集干燥纯净的NH3 |