题目内容
12.利用海水制备部分物质的流程图如下.下列有关说法正确的是( )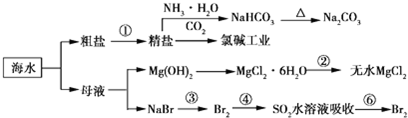
| A. | 电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 | |
| B. | 联合制碱法最终副产物为氯化铵,原子利用率小于100% | |
| C. | 步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 | |
| D. | 海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
分析 由流程可知,海水晒盐得到粗盐、母液,①为粗盐精制,BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸得到NaCl,NaCl、水、氨气与二氧化碳反应生成碳酸氢钠,第②步中由MgCl2•6H2O获得无水氯化镁,在HCl气流中加热防止水解;第③步将溴离子被氧化为溴单质,第④步中溴单质被还原为溴离子,第⑥步中溴离子被氧化为溴单质,此过程的目的是浓缩、富集溴单质,以此来解答.
解答 解:A.Mg为活泼金属,则电解熔融氯化镁制备镁,副产物氯气与氢气反应生成HCl,溶于水可以用于制盐酸,循环利用,故A正确;
B.NaCl、水、氨气与二氧化碳反应生成碳酸氢钠和氯化铵,加热二者均分解,且产物都可循环利用,故B错误;
C.在空气中加热氯化镁晶体,镁离子水解生成的HCl易挥发,不能得到氯化镁,故C错误;
D.海水中溴离子浓度小,溶剂水很多,则海水提溴,先浓缩、再氧化、富集,图中均涉及提溴过程,故D错误;
故选A.
点评 本题考查了海水资源的综合应用,为高频考点,涉及物质的分离提纯等知识,侧重于化学与生活的综合运用,培养了学生运用知识分析问题的能力,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
2.有4种有机物:
①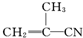 ②
②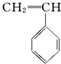 ③
③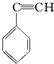 ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为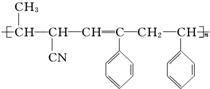 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )
①
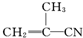 ②
② ③
③ ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
3.决定化学反应速率的主要因素是( )
| A. | 催化剂 | B. | 温度、压强以及反应物的接触面 | ||
| C. | 反应物的浓度 | D. | 参加反应的物质本身的性质 |
20.既可以鉴别乙烷和乙烯,又可以用来除去乙烷中的乙烯的方法是( )
| A. | 通过足量NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni粉催化、加热条件下通入H2 | D. | 通入足量的KMnO4 酸性溶液 |
7.某学生做实验后,采用下列方法清洗所有仪器:
①用稀HNO3清洗做过银镜反应的试管
②用酒精清洗做过碘升华的烧杯
③用盐酸清洗长期盛放FeCl3溶液的试剂瓶
④用酒精清洗盛过苯酚的试管.
你认为他的操作( )
①用稀HNO3清洗做过银镜反应的试管
②用酒精清洗做过碘升华的烧杯
③用盐酸清洗长期盛放FeCl3溶液的试剂瓶
④用酒精清洗盛过苯酚的试管.
你认为他的操作( )
| A. | ②不对 | B. | ③不对 | C. | ①不对 | D. | 全部正确 |
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 范德华力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 范德华力 | D. | 范德华力 氢键 非极性键 |
11. 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
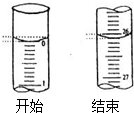
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量.(写出计算过程)
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.甲同学选用的药品除样品外,还应有氯化钡溶液,实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液.用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂.用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.滴定终点的现象是由黄色变成橙色,且半分钟不褪色.
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0mL,终点读数26.10mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 26.01 |
| 第二次 | 20.00 | 1.56 | 30.30 |
| 第三次 | 20.00 | 0.22 | 26.21 |
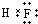 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.