题目内容
13.“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式.下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺: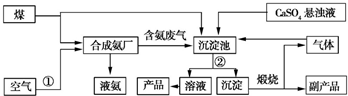
请回答下列问题:
(1)操作②为过滤.
(2)工业合成氨的化学方程式为N2+3H2
 2NH3.
2NH3.(3)沉淀池中生成硫酸铵的化学方程式为CaSO4+CO2+2NH3+H2O
 CaCO3↓+(NH4)2SO4.
CaCO3↓+(NH4)2SO4.(4)在实验室中检验氨气的方法是用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3.
(5)副产品的化学式为CaO.该联合生产工艺中可以循环使用的物质是CO2.
分析 (1)依据流程图可知,操作②为分离固体与液体的操作;
(2)工业上用氮气与氢气在催化剂、高温、高压条件下反应生成氨气;
(3)沉淀池中硫酸钙、二氧化碳、氨气和水发生反应生成硫酸铵和碳酸钙;
(4)氨气为碱性气体,与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性,能够使石蕊变蓝;
(5)碳酸钙煅烧分解生成氧化钙,二氧化碳,二氧化碳能够循环使用,生石灰可以制备氢氧化钙.
解答 解:(1)分离固体与液体操作方法为:过滤;
故答案为:过滤;
(2)氮气与氢气在催化剂、高温、高压条件下反应生成氨气,化学方程式:N2+3H2 2NH3;
2NH3;
N2+3H2 2NH3;
2NH3;
(3)沉淀池中硫酸钙、二氧化碳、氨气和水发生反应生成硫酸铵和碳酸钙,化学方程式:
CaSO4+CO2+2NH3+H2O CaCO3↓+(NH4)2SO4;
CaCO3↓+(NH4)2SO4;
故答案为:CaSO4+CO2+2NH3+H2O CaCO3↓+(NH4)2SO4;
CaCO3↓+(NH4)2SO4;
(4)氨气为碱性气体,通常用石蕊的红色石蕊试纸检验,方法为:用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3;
故答案为:用湿润的红色石蕊试纸检验,若试纸变蓝,则说明含有NH3;
(5)碳酸钙煅烧分解生成氧化钙,二氧化碳,二氧化碳能够循环使用,生石灰为副产品.
故答案为:CaO;CO2.
点评 本题为工艺流程题,考查了物质的制备方法,明确制备流程及发生反应原理为解答关键,注意掌握化学实验基本操作方法,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )
①品红溶液 ②酸性KMnO4 ③溴水 ④滴有酚酞的NaOH ⑤含I2的淀粉溶液.
①品红溶液 ②酸性KMnO4 ③溴水 ④滴有酚酞的NaOH ⑤含I2的淀粉溶液.
| A. | ①④ | B. | ①②③ | C. | ②③⑤ | D. | ③⑤ |
1.苯环结构中,不存在单双键交替结构,可以作为证据的是( )
①苯不能使酸性高锰酸钾溶液褪色;
②苯分子中碳碳键的键长都相等;
③苯能在加热和有催化剂存在的条件下与H2发生加成反应生成环己烷;
④经实验测得邻二甲苯仅有一种结构;
⑤苯在三溴化铁存在的条件下与液溴发生取代反应,但不因化学变化而使溴水褪色.
①苯不能使酸性高锰酸钾溶液褪色;
②苯分子中碳碳键的键长都相等;
③苯能在加热和有催化剂存在的条件下与H2发生加成反应生成环己烷;
④经实验测得邻二甲苯仅有一种结构;
⑤苯在三溴化铁存在的条件下与液溴发生取代反应,但不因化学变化而使溴水褪色.
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
8.已知柠檬醛的结构简式为: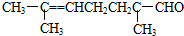 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )
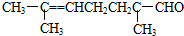 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
18.下列关于价电子构型3s23p4的描述不正确的是( )
| A. | 它的元素符号为S | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 可以与H2化合生成气态化合物 | |
| D. | 其轨道表示式为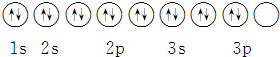 |
2.下列区别苯和己烯的实验方法不正确的是( )
| A. | 分别点燃,有黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,上、下两层红棕色均消失的是己烯 | |
| C. | 分别加入溴水振荡,静置后分层,下层红棕色消失的是己烯 | |
| D. | 分别加入酸性高锰酸钾溶液,振荡,静置后水层紫色消失的是己烯 |
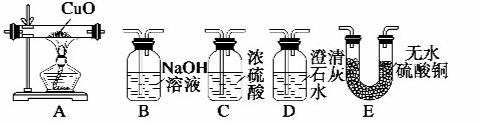
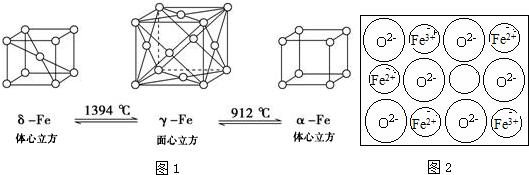
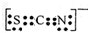 .Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.