17.23Na与23Na+比较,相同的是( )
| A. | 微粒半径 | B. | 化学性质 | C. | 最外层电子数 | D. | 中子数 |
13.用两根金属铂作电极,以KOH溶液作电解质溶液,从两极分别通入CH3OH(g)和O2,则对该燃料电池的下列叙述中正确的是( )
| A. | 负极的电极反应式为 CH3OH+8OH--6e-=CO32-+6H2O | |
| B. | 正极的电极反应式为4OH-+4e-=2H2O+O2↑ | |
| C. | 标准状况下,通入5.6L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH减小 |
12.关于下列各图的叙述正确的是( )
| A. | 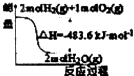 表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ•mol-1 | |
| B. | 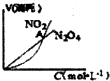 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 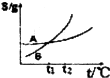 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 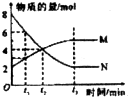 图中在t2时刻正反应速率大于逆反应速率 |
11.关于Li原子结构和性质的判断如下:①与H2O反应比Na剧烈;②它的原子半径比Na小;③它的氧化物暴露在空气中易吸收H2O和CO2;④它的阳离子最外层电子数和钠离子的最外层电子数相同;⑤它在反应中只能作还原剂;⑥Li应保存在煤油中,以隔绝空气;⑦Li在空气中燃烧生成Li2O2.其中错误的组合是( )
| A. | ①④⑥⑦ | B. | ①②③ | C. | ③⑤⑥ | D. | ①⑥⑦ |
10. A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
请回答下列问题:
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
8.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
0 167712 167720 167726 167730 167736 167738 167742 167748 167750 167756 167762 167766 167768 167772 167778 167780 167786 167790 167792 167796 167798 167802 167804 167806 167807 167808 167810 167811 167812 167814 167816 167820 167822 167826 167828 167832 167838 167840 167846 167850 167852 167856 167862 167868 167870 167876 167880 167882 167888 167892 167898 167906 203614
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | B、E、J的离子半径由大到小顺序是E>J>B | |
| C. | G元素的单质不存在同素异形体 | |
| D. | B和J能形成既含离子键又含共价键的化合物 |
 .
. ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓ ;用电子式表示D元素和G元素形成化合物的过程:
;用电子式表示D元素和G元素形成化合物的过程: .
.