题目内容
15.氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况).甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L.请回答下列问题:(1)甲的化学式是AlH3;乙的电子式是
 .
.(2)甲与水反应的化学方程式是AlH3+3H2O=Al(OH)3↓+3H2↑.
(3)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之:取样后加H2SO4溶液,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O.(已知Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间还可能发生反应产生H2,你的判断理由是AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气.
分析 白色沉淀可溶于NaOH溶液,应为Al(OH)3,说明甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g•L-1,则丙的相对原子质量为1.25g•L-1×22.4L=28,应为N2,则乙为NH3,结合对应的物质以及题目要求可解答该题.
解答 解:白色沉淀可溶于NaOH溶液,应为Al(OH)3,说明甲中含有Al和H两种元素,n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则m(H)=0.3mol×2×1g/mol=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g•L-1,则丙的相对原子质量为1.25g•L-1×22.4L=28,应为N2,则乙为NH3,
(1)由以上分析可知甲为AlH3,乙为NH3,电子式为
故答案为:AlH3;
(2)AlH3与水发生氧化还原反应,反应的方程式为AlH3+3H2O=Al(OH)3↓+3H2↑,
故答案为:AlH3+3H2O=Al(OH)3↓+3H2↑;
(3)NH3在加热条件下与CuO反应可生成Cu和气体N2,反应的方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,要判断产物中是否含有CuO,可加入稀硫酸检验溶液是否变蓝,方法是取样后加H2SO4溶液,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;H2SO4溶液,如果溶液变蓝;
(5)AlH3中的H为-1价,NH3中的H为+1价,从化合价的角度可知二者可能发生氧化还原反应生成氢气,
故答案为:AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气.
点评 本题考查无机物的推断,题目难度不大,注意根据先关反应的现象以及数据判断甲乙两种物质,注意相关反应的化学方程式的书写.

| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
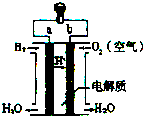
| A. | b是负极 | |
| B. | 需要点燃该电池才能开始工作 | |
| C. | 工作时能观察到淡蓝色火焰 | |
| D. | 氢氧燃料电池是一种高效环境友好的发电装置 |
| A. | 4、3、6 | B. | 4、3、5 | C. | 2、5、4 | D. | 4、6、4 |
| A. | 先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解 | |
| B. | 先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀 | |
| C. | 先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀 | |
| D. | 先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀 |
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电解质溶液是酸性溶液 | |
| C. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| D. | 负极发生的反应是:Zn-2e-+H2O=ZnO+2H+ |

 .
.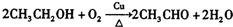 .
.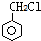 的属于芳香族化合物的同分异构体有3种.
的属于芳香族化合物的同分异构体有3种.