题目内容
16.已知下热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
③C(s)+$\frac{1}{2}$O2 (g)=CO (g)△H=-110.5kJ/mol
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
回答下列问题:
(1)C的燃烧热△H=-393.5kJ/mol;
(2)10g水蒸气生成同温度的液态水,放出的热量为24.4KJ;
(3)CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△=-283KJ/mol.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,二氧化碳是稳定氧化物,据此分析解答;
(2)由①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
依据盖斯定律①-②得到H2O(g)=H2O(1)△H=-44KJ/mol,据此计算10g水蒸气生成同温度的液态水,放出的热量;
(3)利用盖斯定律,结合反应③④求得.
解答 解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,由④C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,二氧化碳是稳定氧化物,且C的物质的量为1mol,所以-393.5kJ/mol是C的燃烧热,故答案为:-393.5kJ/mol;
(2)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
依据盖斯定律①-②得到H2O(g)=H2O(1)△H=-44KJ/mol
所以当1mol液态水变为水蒸气时H2O(l)=H2O(g)△H=+44KJ/mol,10g水蒸气生成同温度的液态水,放出的热量为$\frac{44}{18}$×10=24.4KJ,故答案为:24.4KJ;
(3)已知:③C(s)+$\frac{1}{2}$O2 (g)=CO (g)△H=-110.5kJ/mol
④C(s)+O2 (g)=CO2 (g)△H=-393.5kJ/mol
据盖斯定律,④-③得:CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△=-283KJ/mol,故答案为:CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△=-283KJ/mol.
点评 本题考查了根据热化学方程式的计算以及盖斯定律的应用,有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:
1、所求反应中的反应物在哪个反应了?是反应物还是生成物?
2、所给反应中哪些物质是所求反应中没有的?
3、如何才能去掉无用的?然后,通过相互加减,去掉无关物质.将所对应的△H代入上述化学方程式的加减中就可以了.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Na>Mg>Al | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
| A. | 该晶体类型是原子晶体 | |
| B. | 晶体的空间最小环共有6个原子构成 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
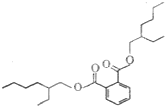 塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )
塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )| A. | 易溶于水,其水溶液有丁达尔效应 | B. | 在稀硫酸中不能稳定存在 | ||
| C. | 不能发生还原反应 | D. | 不能发生氧化反应 |
| A. | ①④⑥⑦ | B. | ①②③ | C. | ③⑤⑥ | D. | ①⑥⑦ |
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③热稳定性:HCl>H2S>PH3
④还原性:F->Cl->Br-.
| A. | ①②④ | B. | ②③④ | C. | ①②③ | D. | ①②③④ |
| A. | S.O.K | B. | Na.C.O | C. | H.O.S | D. | H.N.O |
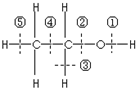 乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的( )
乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的( )| A. | 乙烯分子为平面结构 | |
| B. | 乙烯可用作植物生长的调节剂 | |
| C. | 乙醇在铜催化下和氧气反应键①和③断裂 | |
| D. | 乙醇和乙酸、浓硫酸共热时键②断裂 |
 一种锌锰干电池外壳的纸层包装印有如图所示的文字,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加人MnO2氧化吸收H2)
一种锌锰干电池外壳的纸层包装印有如图所示的文字,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加人MnO2氧化吸收H2)