题目内容
8.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | B、E、J的离子半径由大到小顺序是E>J>B | |
| C. | G元素的单质不存在同素异形体 | |
| D. | B和J能形成既含离子键又含共价键的化合物 |
分析 短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于ⅦA族,B处于ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;H、I、J的化合价分别为+3、+2、+1,分别处于Ⅲ族A、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知H为Al、I为Mg、J为Na,据此进行解答.
解答 解:短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于ⅦA族,B处于ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;H、I、J的化合价分别为+3、+2、+1,分别处于Ⅲ族A、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知H为Al、I为Mg、J为Na,
A.I为Mg元素,DB2为二氧化碳,镁在二氧化碳中的燃烧生成MgO和碳单质,故A错误;
B.B、E、J分别为:O、Cl、Na,Na+、O2-离子核外电子层数相等,核电荷数越大离子半径越小,Cl-的电子层最多,其离子半径最大,则离子半径大小顺序为:Cl->O2->Na+,即:E>B>J,故B错误;
C.G为P元素,磷的单质有红磷和白磷,存在同素异形体,故C错误;
D.B、J分别为:O、Na,Na与O形成的化合物Na2O2既含离子键又含共价键,故D正确;
故选D.
点评 本题考查性质结构位置关系的应用,题目难度中等,根据半径与化合价推断元素是解题关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案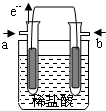 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )| A. | a为负极,通入的气体为氢气 | |
| B. | 正极的电极反应式为:Cl2+2e-=2Cl- | |
| C. | 电流由b极流出,经外电路到a极 | |
| D. | 原电池内部,H+移向负极,Cl-移向正极 |
| A. | 该有机物含碳.氢.氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳.氢原子个数之比是2:3 | |
| D. | 该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
| A. | 负极的电极反应式为 CH3OH+8OH--6e-=CO32-+6H2O | |
| B. | 正极的电极反应式为4OH-+4e-=2H2O+O2↑ | |
| C. | 标准状况下,通入5.6L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH减小 |
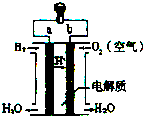
| A. | b是负极 | |
| B. | 需要点燃该电池才能开始工作 | |
| C. | 工作时能观察到淡蓝色火焰 | |
| D. | 氢氧燃料电池是一种高效环境友好的发电装置 |
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | 使用该漂白剂的最佳pH为3 | |
| D. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
 现有丙炔和氢气的混合气体5L,其中氢气在混合气体中的体积分数为x,在催化剂作用下,经充分反应后得到的气体的体积为V L(所有体积均在同温同压下测定).
现有丙炔和氢气的混合气体5L,其中氢气在混合气体中的体积分数为x,在催化剂作用下,经充分反应后得到的气体的体积为V L(所有体积均在同温同压下测定).
 .
.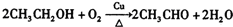 .
.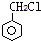 的属于芳香族化合物的同分异构体有3种.
的属于芳香族化合物的同分异构体有3种.