题目内容
14.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同周期,也不同族.X原子最外层电子数是核外电子层数的三倍,Y的最高价与最低价的代数和等于6.N是短周期主族元素中原子半径最大的非金属元素.(1)X元素位于元素周期表的位置是第二周期,第VIA族;
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:Si+2OH-+H2O═SiO32-+2H2↑
(3)Y与Z相比,非金属性较强元素的原子结构示意图为
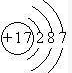 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓(4)请将X、Z、M、N元素原子半径从大到小排序:Si>S>O>H(用元素符号表示)
分析 X原子最外层电子数是核外电子层数的三倍,故X为氧,Z为S元素;X在第二周期,Y与Z同周期,Y在第三周期,则M只能为H元素;Y的最高化合价与最低化合价代数和为6,设最高化合价为a,则最低负化合价为a-8,则a+(a-8)=6,所以a=7,则Y为Cl元素;N为第三周期半径最大的非金属元素,则N为Si,
(1)X为O,位于第二周期第ⅥA族;
(2)Si与NaOH溶液反应生成硅酸钠和氢气;
(3)Y与Z相比,非金属性较强元素为Cl,可利用单质之间的置换反应说明;
(4)电子层越多,原子半径越大;同周期,原子序数大的半径小.
解答 解:根据题意推断X为氧元素,Z为S元素;X在第二周期,Y与Z同周期,Y在第三周期,则M只能为H元素;Y的最高化合价与最低化合价代数和为6,设最高化合价为a,则最低负化合价为a-8,则a+(a-8)=6,所以a=7,则Y为Cl元素;N为第三周期半径最大的非金属元素,则N为Si,
(1)X为O,位于第二周期第ⅥA族,故答案为:二;VIA;
(2)Si与NaOH溶液反应生成硅酸钠和氢气,离子反应为Si+2OH-+H2O═SiO32-+2H2↑,故答案为:Si+2OH-+H2O═SiO32-+2H2↑;
(3)Y与Z相比,非金属性较强元素为Cl,其原子结构示意图为 ,氯气能将硫单质置换出来,发生Cl2+S2-═2Cl-+S↓可证明,
,氯气能将硫单质置换出来,发生Cl2+S2-═2Cl-+S↓可证明,
故答案为: ;Cl2+S2-═2Cl-+S↓;
;Cl2+S2-═2Cl-+S↓;
(4)电子层越多,原子半径越大;同周期,原子序数大的半径小,原子半径为N>Z>X>M,即Si>S>O>H,故答案为:Si>S>O>H.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、周期表的结构及元素化合物知识为解答的关键,侧重知识综合应用能力的考查,题目难度不大.

| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
C(石墨)+02(g)=C02(g),燃烧l mol C(石墨)放热393.51kJ.
C(金刚石)+02(g)=C02(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的正确结论是( )
| A. | 金刚石比石墨更稳定 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转变为石墨是物理变化 | D. | 石墨的能量比金刚石低 |
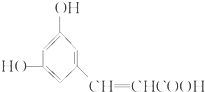
| A. | X分子中最多可有9个碳原子共平面 | |
| B. | X可以发生取代、加成、消去、聚合等反应 | |
| C. | 1 mol X与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na | |
| D. | 苯环上的取代基与X完全相同的X的同分异构体有5种 |
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓硝酸 | D. | 稀盐酸 |
| A. | 保持体积不变,充入H2使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 保持压强不变,充入N2使体系体积增大 |
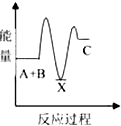
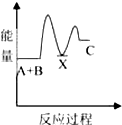


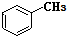 和
和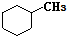 .其中互为同分异构体的是①③④(填序号).
.其中互为同分异构体的是①③④(填序号). ;用电子式表示D元素和G元素形成化合物的过程:
;用电子式表示D元素和G元素形成化合物的过程: .
.