16.常见的离子晶体类型有五种,右图是其中的一种空间构型.则该晶体的化学式可能为( )

| A. | YX4 | B. | XY2 | C. | YX | D. | YX2 |
14.室温下,下列说法正确的是( )
| A. | AgCl水溶液的导电性很弱,所以AgCl是弱电解质 | |
| B. | 所有盐类都能促进水的电离 | |
| C. | 碳酸钠溶液加水稀释过程中,溶液中各离子浓度都减小 | |
| D. | 将1 mL pH=3的HX溶液稀释到10 mL,若溶液的pH<4,则HX为弱酸 |
11.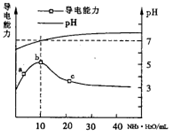 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
所得溶液pH及导电性变化如图.下列分析不正确的是( )
 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)×c(OH-)=KW=1.0×10-14 |
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
9.Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂.工业上制得的Na2S2O3•5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质.为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.(Na2S2O3+H2SO4γNa2SO4+SO2↑+S↓+H2O)
测得有关实验数据如下(标准状况):
(摩尔质量:Na2S2O3•5H2O 248g/mol; Na2SO3126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上实验数据,该样品中d(填写选项字母).
A.仅含有Na2S2O3•5H2O
B.含有和Na2S2O3•5H2O和Na2SO3,无Na2SO4
C.含有Na2S2O3•5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的S02体积(b L)的值(可用含a的关系式表示).
8.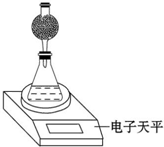 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
(1)他们能完成哪些因素对速率影响的探究?
探究同体积下HNO3浓度对该反应剧烈程度的影响、探究接触面积对该反应剧烈程度的影响、探究温度对该反应剧烈程度的影响.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(4)该实验小组用如图实验装置进行实验.
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有量筒、秒表.
②干燥管中应放置的试剂是BC.
A.碱石灰 B.无水CaCl2C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
0 167702 167710 167716 167720 167726 167728 167732 167738 167740 167746 167752 167756 167758 167762 167768 167770 167776 167780 167782 167786 167788 167792 167794 167796 167797 167798 167800 167801 167802 167804 167806 167810 167812 167816 167818 167822 167828 167830 167836 167840 167842 167846 167852 167858 167860 167866 167870 167872 167878 167882 167888 167896 203614
 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.(1)他们能完成哪些因素对速率影响的探究?
探究同体积下HNO3浓度对该反应剧烈程度的影响、探究接触面积对该反应剧烈程度的影响、探究温度对该反应剧烈程度的影响.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(4)该实验小组用如图实验装置进行实验.
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有量筒、秒表.
②干燥管中应放置的试剂是BC.
A.碱石灰 B.无水CaCl2C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
