题目内容
12.某叶绿素的化学式为C55H72N4O6Mg,其中人体代谢的中间产物为CO(NH2)2(1)该叶绿素所含元素中,基态原子第一电离能最大的是N(填元素符号,下同);处于s区的元素有H、Mg
(2)已知CO(NH2)2分子中C,N、0原子均达8电子稳定结构,其中N的杂化轨道类型为sp3;在CO(NH2)2晶体中存在BCD(填序号)A.非极性键 B.极性键 C.氢键 D范德华力
(3)CO(NH2)2的熔点远远低于NaCl,其原因是CO(NH2)2为分子晶体,微粒间为分子间作用力,NaCl为离子晶体,微粒间为离子键,离子键比分子间作用力大很多
(4)工业上,用惰性电极电解法除去域性溶液中的CO(NH2)2,产物均为无毐无富常见物质.则阳极除去CO(NH2)2的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
.
分析 (1)元素的非金属性越强,其第一电离能越大,但是由于N的2p处于半充满状态,故第一电离能大于O,最外层电子不超过2个即位于s区,据此解答;
(2)根据价层电子对互斥理论确定N原子杂化类型;依据晶体类型以及形成元素判断化学键;
(3)晶体熔沸点高低与其类型有关,一般来说:原子晶体熔点高于离子晶体,离子晶体高于分子晶体;
(4)由阳极排出液中含有大量的碳酸盐成份,则尿素在阳极参与反应,N元素的化合价升高,以此来书写电极反应.
解答 解:(1)元素的非金属性越强,其第一电离能越大,所含有元素中非金属性为:O>N>C,但是由于N的2p处于半充满状态,故第一电离能大于O,最外层电子不超过2个即位于s区,故答案为:N;Mg和H;
(2)尿素中氮原子形成了3个σ键,同时还有一对孤电子,电子对数为3+1=4,故杂化轨道为sp3,CO(NH2)2为分子晶体,故存在分子间作用力,N原子易形成氢键,C与O,N与H等形成的均是极性共价键,故答案为:sp3;BCD;
(3)尿素与分子晶体,微粒间为分子间作用力,氯化钠为离子晶体,微粒间为离子键,离子键比分子间作用力大很多,故尿素的熔点远远低于氯化钠,故答案为:CO(NH2)2为分子晶体,微粒间为分子间作用力,NaCl为离子晶体,微粒间为离子键,离子键比分子间作用力大很多;
(4)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O.
点评 本题以叶绿素的组成为载体,考查的是元素第一电离能大小比较、杂化类型判断、氢键、电化学的知识等,难度较大.

练习册系列答案
相关题目
4.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素描述正确的是( )
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
1.下列分子中,VSEPR模型名称和分子立体构型名称相同,且分子中各原子最外层都满足8电子稳定结构的是( )
| A. | CH4 | B. | PCl3 | C. | SiCl4 | D. | XeF4 |
2.下列各有机物的分类或命名正确的是( )
| A. | 对甲基苯酚属于芳香烃 | B. | 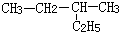 2-乙基丁烷 2-乙基丁烷 | ||
| C. | 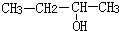 3-丁醇 3-丁醇 | D. | 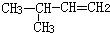 3-甲基-1-丁烯 3-甲基-1-丁烯 |

 .
.
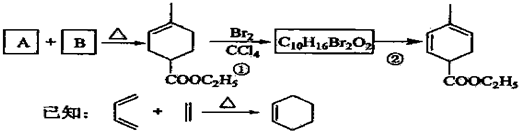
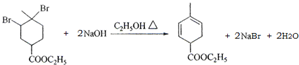 .
.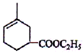 .
.