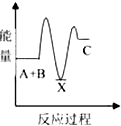
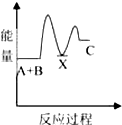
题目内容
15.写出下列物质的电离方程式:(1)H2S:H2S?H++HS-
(2)NH4HSO4NH4HSO4=NH4++H++SO42-
写出下列物质水解反应的离子方程式:
(3)CuSO4Cu2++H2O?Cu(OH)2+2H+
(4)Na2CO3CO32-+H2O?HCO3-+H+
写出下列反应的离子方程式:.
(5)硫酸铝溶液和碳酸氢钠溶液混合Al3++3HCO3-=Al(OH)3↓+3CO2↑.
分析 (1)硫化氢为多元弱酸,分步电离,以第一步为主,用可逆号;
(2)硫酸氢氨为强电解质,在水中完全电离生成氨根离子、氢离子、硫酸根离子;
(3)铜离子水解生成氢氧化铜和氢离子,用可逆号;
(4)碳酸根离子为多元弱酸的酸根离子,分步水解,以第一步为主,用可逆号;
(5)铝离子与碳酸氢根离子发生双水解生成氢氧化铝、二氧化碳.
解答 解:(1)硫化氢电离方程式:H2S?H++HS-,故答案为:H2S?H++HS-;
(2)硫酸氢氨为强电解质,完全电离,电离方程式:NH4HSO4=NH4++H++SO42-,故答案为:NH4HSO4=NH4++H++SO42-;
(3)铜离子水解生成氢氧化铜和氢离子,离子方程式:Cu2++H2O?Cu(OH)2+2H+,故答案为:Cu2++H2O?Cu(OH)2+2H+;
碳酸根离子水解的离子方程式:CO32-+H2O?HCO3-+H+,故答案为:CO32-+H2O?HCO3-+H+;
(5)铝离子与碳酸氢根离子发生双水解生成氢氧化铝、二氧化碳,离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查了离子方程式的书写,侧重考查弱电解质的电离和盐类水解,明确电解质的强弱及电离方式、盐类水解规律是解题关键,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
18.下列有关晶胞的叙述正确的是( )
| A. | 晶胞是晶体中最小的结构基本单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都完全属于该晶胞 | |
| D. | 晶胞都是正方体 |
3.将H2S和SO2气体分别通入下列溶液中,只有一种气体反应是( )
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
20.一定量的锌片与过量2mol•L-1的盐酸跟反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 通入一定量的HCl气体 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入一定量6mol•L-1的硝酸溶液 | D. | 加入适量的CH3COONa固体 |
7.已知短周期元素形成的离子aA+、bB2+、cC-、dD2-均具有相同的电子层结构,下列判断正确的是( )
| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
4.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
 .
.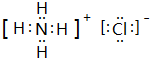 ,A2C2的电子式为
,A2C2的电子式为 .
.