题目内容
13.某兴趣小组欲利用下列装置1探究A反应中Cl2的产生速率.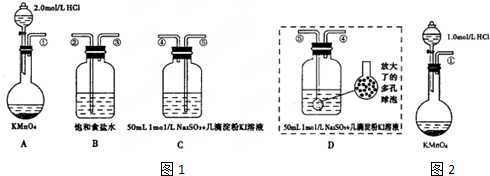
(1)完善A中反应:2KMnO4+16HC1═2MnCl2+5Cl2↑+2KCl+8H2O,A、B、C装置的接口连接顺序为:①→②→③→⑤→④〔填数肀序号).
(2)当黄绿色气体缓缓慢进人C时,一段时间后C中溶液才变蓝,C中溶液变蓝前发生反应的离子方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+;少量淀粉KI溶液的作用是指示剂
(3)若实验测得速率值偏小,小组同学作如图2实验改进和反思,请帮助完成,
I、用D裝置代替c装置,目的是利用多孔球泡将气体分散为小气泡,增大气体与溶液的接触面积,加快吸收速率,减少Cl2逸出
Ⅱ、导致測得值偏小的原因可能还有:
①Cl2扩散需要一段时间
②C中亚硫酸钠溶液浓度偏小,气体吸收速率小于气体生成速率(任答一点)
(4)进一步探究:仅将A装置做如图2改变.则此改进欲探究的是浓度对反应速率的影响.
分析 (1)依据氧化还原反应中得失电子守恒以及元素守恒配平即可;BC装置分别为洗气和验证,故应“长进短出”,据此解答即可;
(2)亚硫酸钠具有还原性,氯气具有氧化性,能氧化亚硫酸根生成硫酸根,碘遇淀粉变蓝;据此解答即可;
(3)I、D装置与C装置的不同点在于D中加了一个多孔球泡,据此多孔气泡用途回答;
II、若气体吸收速率过慢,可以导致氯气的损失,亚硫酸钠的浓度太小,也可以导致气体吸收不完全,据此解答即可;
(4)将A装置做如图2改变,从图中得出改变的是HCl的浓度,据此解答即可.
解答 解:(1)KMnO4中Mn由+5价降低到MnCl2中的+2价,故发生还原反应,化合价变化为5,HCl中Cl从-1价升高到0价,故化合价变化为1,故氯气前系数为5,氯化锰为2,据此依据质量守恒定律得出:2KMnO4+16HC1═2MnCl2+5Cl2↑+2KCl+8H2O,B为除去氯气中HCl杂质气体,故应从②进入,C为验证气体装置,故应从⑤进入,故答案为:2、16、2、5、2、8H2O;②③⑤④;
(2)亚硫酸钠具有还原性,氯气具有氧化性,能氧化亚硫酸根生成硫酸根,在溶液中本身被还原生成氯离子,离子反应方程式为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+,若溶液中存有亚硫酸根,就不会有碘单质生成,即此时淀粉KI试纸不变蓝,只有亚硫酸根完全反应,通入的氯气置换出KI中的碘生成碘碘单质,此时溶液变蓝,故淀粉KI为指示剂,故答案为:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;指示剂;
(3)I、D装置与C装置的不同点在于D中加了一个多孔球泡,利用多孔球泡可以将气体分散为小气泡,增大气体与溶液的接触面积,加快吸收速率,减少Cl2逸出,故答案为:利用多孔球泡将气体分散为小气泡,增大气体与溶液的接触面积,加快吸收速率,减少Cl2逸出;
II、若气体吸收速率过慢,可以导致氯气的损失,亚硫酸钠的浓度太小,也可以导致气体吸收不完全,故答案为:C中亚硫酸钠溶液浓度偏小,气体吸收速率小于A中气体生成速率;
(4)观察图可知:图2中把A中2.0mol/L的HCl换成了1.0mol/L的HCl,故此改进要探究的是浓度对反应速率的影响,答案为:浓度对反应速率的影响.
点评 本题主要考查的是化学反应速率的影响因素探究,本题中涉及氧化还原反应配平、气体装置连接等,有一定难度.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 丁烯 | B. | 乙苯 | C. | 苯甲醇 | D. | 丙酸甲酯 |
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 吸热反应需要加热后才能发生 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂不参加化学反应 | |
| D. | 任何化学反应,都需要催化剂 |
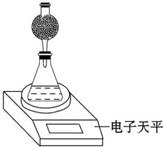 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.(1)他们能完成哪些因素对速率影响的探究?
探究同体积下HNO3浓度对该反应剧烈程度的影响、探究接触面积对该反应剧烈程度的影响、探究温度对该反应剧烈程度的影响.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(4)该实验小组用如图实验装置进行实验.
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有量筒、秒表.
②干燥管中应放置的试剂是BC.
A.碱石灰 B.无水CaCl2C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 开发太阳能、水能、风能等新能源、减少使用煤、石油等化石燃料 | |
| D. | 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
| A. | 金属元素与非金属元素间只能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物? | |
| C. | 离子化合物中可能有共价键? | |
| D. | 共价化合物中可能有离子键? |
| A. | R一定是气态 | |
| B. | R一定是离子化合物 | |
| C. | R一定是共价化合物 | |
| D. | R可能是离子化合物,也可能是共价化合物 |