题目内容
17.乙醛与银氨溶液反应的化学方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O乙醛与新制Cu(OH)2悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
分析 乙醛与银氨溶液反应生成醋酸铵、银单质、氨气和水,据此写出反应的化学方程式;乙醛和新制Cu(OH)2的反应发生氧化反应,乙醛分子中的醛基被氧化为羧基,氢氧化铜被还原为氧化亚铜红色沉淀.
解答 解:乙醛与银氨溶液发生银镜反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O,乙醛和新制Cu(OH)2的反应发生氧化反应,乙醛分子中的醛基被氧化为羧基,氢氧化铜被还原为氧化亚铜红色沉淀:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O;CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
点评 本题主要考查乙醛的化学性质、化学方程式的书写知识,难度不大,根据所学知识即可完成.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
20.某混合溶液中可能含有下列离子中的若干种:${NH}_{4}^{+}$、Al3+、Fe2+、Fe3+、${SO}_{4}^{2-}$、${NO}_{2}^{-}$、${NO}_{3}^{-}$、${CO}_{3}^{2-}$,现取三份20mL该溶液于锥形瓶,分别进行如下实验:
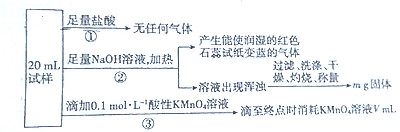
根据上述实验,以下说法不正确的是( )

根据上述实验,以下说法不正确的是( )
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
2.下列关于元素周期律和元素周期表的说法中正确的是( )
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |
6.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Na>Mg>Al | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
7.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
| A. | 该晶体类型是原子晶体 | |
| B. | 晶体的空间最小环共有6个原子构成 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
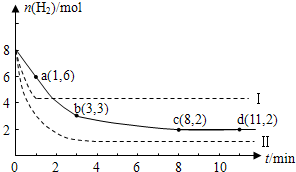
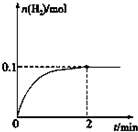 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: