题目内容
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
分析 (1)根据m=nM=cVM来计算;
(2)①如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
②先求出标准NaOH溶液体积,判断数据的合理性,然后求出标准NaOH溶液的平均体积,然后根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$来解答.
③排去碱式滴定管中气泡的方法:碱式滴定管应将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出,以排除气泡;
④根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)需要的氢氧化钠的m=nM=cVM=0.1L×0.10mol•L-1×40g/mol=0.4g,
故答案为:0.4;
(2)①滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,即酚酞在酸中为无色,在碱性溶液中显浅红色,
故答案为:最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色;
②3组数据均合理,得出V(标准)=$\frac{22.62+22.72+22.80}{3}$=L=22.71mL,
c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.10mol•{L}^{-1}×22.71mL}{20.00mL}$≈0.11mol/L;
故答案为:0.11mol/L;
③碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,故答案为:丙;
④A.滴定终点读数时俯视读,造成V(标准)偏小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏小,故A错误;
B.酸式滴定管使用前,水洗后未用待测盐酸润洗,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏小,故B错误;
C.锥形瓶水洗后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)不变,故C错误;
D.称量NaOH固体中混有Na2CO3固体,等质量的碳酸钠和氢氧化钠,碳酸钠消耗的盐酸偏低,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,故D正确;
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3,等物质的量的碳酸钠与氢氧化钠消耗的氯化氢相等,滴定时消耗的标准液体积不变,测定结果不变,故E错误;
F.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,故F正确;
故答案为:DF.
点评 本题考查了溶液的配制、中和滴定及误差分析,题目难度中等,要求学生掌握中和滴定的操作方法及误差分析的方法,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

| A. | 压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大 | |
| B. | 速率关系:2v(CO2)=v(CO) | |
| C. | 转移电子数随温度升高而增多 | |
| D. | 气体密度随着焦炭的增加而增大 |
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化.
| A. | 全部 | B. | ②③④⑤⑥ | C. | ④⑤⑥ | D. | ⑤⑥ |
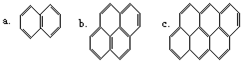 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )| A. | 100% | B. | 56% | C. | 97.3% | D. | 93.8% |
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |
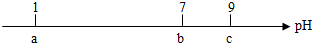
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烯 | D. | 混合气体中一定有乙炔 |
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: