6.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最稳定的是Ar(填元素符号).最活泼的金属是K(填元素符号),离子结构示意图为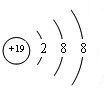 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
5.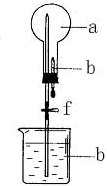 在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
 在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/LNaOH溶液 |
| C | Cl2 | 饱和NaOH溶液 |
| D | NH3 | 1mol/L盐酸 |
| A. | A | B. | B | C. | C | D. | D |
4.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
3.在人类社会的发展进程中,金属起着重要的作用.下列说法正确的是( )
| A. | 地球上绝大多数金属元素是以游离态存在于自然界中的 | |
| B. | 在化学反应中,金属容易失去电子,是还原剂 | |
| C. | 多数合金的熔点高于组成它的成分的金属的熔点 | |
| D. | 硅单质是良好的半导体,所以它是金属元素 |
2.下列有关环境保护的说法中不正确的是( )
| A. | 含氮、磷化合物的生活污水大量排放可使水体富营养化 | |
| B. | 各国大量排放SO2是全球气候变暖的主要原因 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 废旧电池中的汞、镉、铅等重金属对土壤和水源会造成污染 |
1.已知锌与稀盐酸反应放热.某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度为1.00mol•L-1、2.00mol•L-1,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K,每次实验稀盐酸的用量为25.0mL.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下:
①计算在30-40s范围内盐酸的平均反应速率v(HCl)=0.56mol/(L•s).(忽略溶液体积变化,不需要写出计算过程).
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
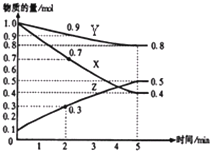
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
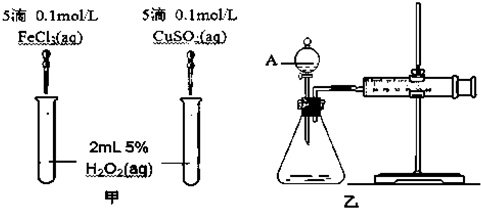
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.

(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.

20.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
18.有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是( )
0 167649 167657 167663 167667 167673 167675 167679 167685 167687 167693 167699 167703 167705 167709 167715 167717 167723 167727 167729 167733 167735 167739 167741 167743 167744 167745 167747 167748 167749 167751 167753 167757 167759 167763 167765 167769 167775 167777 167783 167787 167789 167793 167799 167805 167807 167813 167817 167819 167825 167829 167835 167843 203614
| 第一组 | He | -268.8 | (a) | -249.5 | Ar | -185.8 | Kr | -151.7 |
| 第二组 | F2 | -187.0 | Cl2 | -33.6 | (b) | 58.7 | I2 | 184.0 |
| 第三组 | (c) | 19.4 | HCl | -84.0 | HBr | -67.0 | HI | -35.3 |
| 第四组 | H2O | 100.0 | H2S | -60.2 | (d) | -42.0 | H2Te | -1.8 |
| A. | abc的化学式分别为Ne2、Br2、HF | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr<d | |
| C. | 第三组物质溶于水后,溶液的酸性c最强 | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
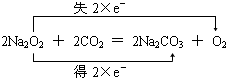 .
.