题目内容
18.有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是( )| 第一组 | He | -268.8 | (a) | -249.5 | Ar | -185.8 | Kr | -151.7 |
| 第二组 | F2 | -187.0 | Cl2 | -33.6 | (b) | 58.7 | I2 | 184.0 |
| 第三组 | (c) | 19.4 | HCl | -84.0 | HBr | -67.0 | HI | -35.3 |
| 第四组 | H2O | 100.0 | H2S | -60.2 | (d) | -42.0 | H2Te | -1.8 |
| A. | abc的化学式分别为Ne2、Br2、HF | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr<d | |
| C. | 第三组物质溶于水后,溶液的酸性c最强 | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
分析 A.第一组是稀有气体熔沸点比较,稀有气体都是单原子分子;第二组是卤素单质熔沸点比较,卤素单质都是双原子分子;第三组是卤素氢化物熔沸点比较,HF中含有氢键熔沸点最高;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.元素的非金属性越强,元素吸引电子能力越强,其氢化物越难电离;
D.氢键影响氢化物的熔沸点.
解答 解:A.第一组是稀有气体熔沸点比较,稀有气体都是单原子分子;第二组是卤素单质熔沸点比较,卤素单质都是双原子分子;第三组是卤素氢化物熔沸点比较,HF中含有氢键熔沸点最高,所以c是HF,所以abc的化学式分别是Ne、Br2、HF,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,第四族是氧族元素氢化物熔沸点比较,所以d是H2Se,非金属性Br>Se,所以化合物的稳定顺序为:HBr>d,故B错误;
C.元素的非金属性越强,元素吸引电子能力越强,其氢化物越难电离,第三组是卤族元素氢化物,c是HF,F元素非金属性最强,则HF的水溶液酸性最弱,故C错误;
D.氢键影响氢化物的熔沸点,水中含有氢键导致水的熔沸点最高,故D正确;
故选D.
点评 本题考查同一族元素氢化物、单质熔沸点比较,侧重考查学生分析、判断及总结归纳能力,明确同一组元素或化合物特点及与熔沸点关系是解本题关键,涉及氢化物的稳定性、酸性等知识点,注意HF分子较稳定但其水溶液酸性较弱,HI、HBr都是强酸,为易错点,

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.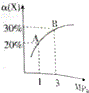 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
9.(1)硒(Se)是人体必需微量元素.已知在周期表中,硒与氧同主族,与钙同周期,试回答下列问题:
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4;
(2)如表是某一周我国部分城市空气质量周报,阅读并回答下列问题.
①最容易出现酸雨的城市应是重庆.
②二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L.为减少二氧化硫排放量,下列措施中,可采取的是AB.
A.用天然气代替煤炭做民用燃料
B.采用燃料脱硫技术
C.向已酸化的土壤中加石灰
D.植树造林.
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4;
(2)如表是某一周我国部分城市空气质量周报,阅读并回答下列问题.
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 |
| 北京 | 92 | TSP | Ⅱ |
| 上海 | 74 | Ⅱ | |
| 济南 | 76 | TSP | Ⅱ |
| 重庆 | 98 | Ⅱ |
②二氧化硫是常见的大气污染物之一,我国规定空气中二氧化硫含量不得超过0.02mg/L.为减少二氧化硫排放量,下列措施中,可采取的是AB.
A.用天然气代替煤炭做民用燃料
B.采用燃料脱硫技术
C.向已酸化的土壤中加石灰
D.植树造林.
6.下列不能说明氯元素的非金属性比硫元素强的事实( )
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |
13.1mol某烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成四种不同的一氯取代物.该烃的结构简式是( )
| A. | 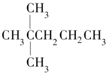 | B. | CH3CH2CH2CH2CH3 | C. | 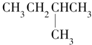 | D. | 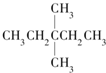 |
3.在人类社会的发展进程中,金属起着重要的作用.下列说法正确的是( )
| A. | 地球上绝大多数金属元素是以游离态存在于自然界中的 | |
| B. | 在化学反应中,金属容易失去电子,是还原剂 | |
| C. | 多数合金的熔点高于组成它的成分的金属的熔点 | |
| D. | 硅单质是良好的半导体,所以它是金属元素 |
8.金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有 ( )
| A. | 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化 | |
| B. | 晶体中共价键的键长:金刚石中C-C<石墨中C-C | |
| C. | 晶体的熔点:金刚石<石墨 | |
| D. | 晶体中共价键的键角:金刚石>石墨. |

 (写出其结构简式).
(写出其结构简式). .
. .
. )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
 .
. .
. .
.