题目内容
1.已知锌与稀盐酸反应放热.某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度为1.00mol•L-1、2.00mol•L-1,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K,每次实验稀盐酸的用量为25.0mL.(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
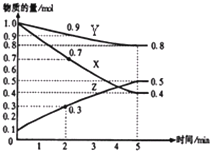
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
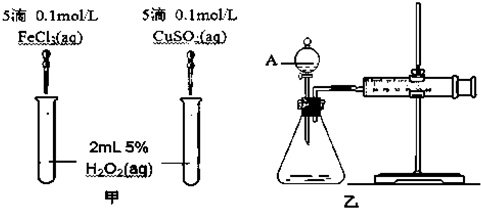
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
分析 (1)根据实验的目的和影响化学反应速率的因素来设计实验,注意对照实验的设计是关键,采用控制变量法来比较外界条件对反应速率的影响;
(2)①计算氢气的平均反应速率v(H2),根据反应速率之比等于方程式的系数之比计算用盐酸表示的速率;
②根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,据影响反应速率的因素来判断;
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,据影响反应速率的因素来判断;
(3)根据浓度以及原电池原理的应用来确定化学反应速率的变化情况;
(4)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(5)①定性分析:根据反应生成气体的快慢分析;
②定量分析:该反应是通过反应速率分析的,所以根据v=$\frac{△V}{△t}$判断.
解答 解:(1)(Ⅰ)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,实验①②探究盐酸浓度对该反应速率的影响,所以固体的表面积应该是不同的,实验①是粗颗粒,但是实验②是细颗粒;
(Ⅱ)探究温度对该反应速率的影响,则固体的表面积以及盐酸的浓度应该是一样的,所以实验③应该是粗颗粒的固体,盐酸的浓度选择2.00;
(Ⅲ)探究锌规格(粗、细)对该反应速率的影响,要求试验温度以及盐酸的浓度是相等的,实验①盐酸浓度是2.00,所以实验④应该是细颗粒,盐酸浓度是2.00;
故答案为:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | ③ ④ |
| ② | 298 | 粗颗粒 | 2.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
②根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,所以反应速率最大的时间段是40~50s,可能原因是反应放热,温度高,反应速率快,故答案为:40~50s;反应放热;
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,所以反应速率最大的时间段是90~100s,可能原因是反应进行过程中,盐酸浓度减小,反应速率慢,故答案为:90~100s;盐酸浓度降低;
(3)在硫酸中加入A.蒸馏水、C.NaCl溶液都相当于将硫酸稀释,盐酸中氢离子浓度减小,所以速率减慢,在反应中加入氯化铜,则金属锌会置换出金属铜,形成Cu、Zn、硫酸原电池,会加快反应速率,故选AC;
(4)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.6mol:0.2mol:0.4mol=3:1:2,则反应的化学方程式为3X+?2Z,
故答案为:3X+Y?2Z;
(5)①定性分析:该反应中产生气体,所以可根据生成气泡的快慢判断,故答案为:生成气泡的快慢判断;
②定量分析:该反应是通过生成气体的反应速率分析判断的,所以根据v=$\frac{△V}{△t}$知,需要测量的数据是产生40ml气体所需要的时间,故答案为:产生40ml气体所需要的时间.
点评 本题考查化学反应速率的影响因素及反应速率的计算,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
16.如图,有关零排放车载燃料电池叙述正确的是( )
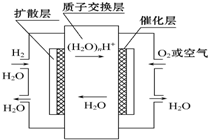

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
6.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最稳定的是Ar(填元素符号).最活泼的金属是K(填元素符号),离子结构示意图为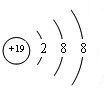 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
13.下列过程中,不需要破坏化学键的是( )
| A. | 氯化钠溶于水 | B. | 氯化氢溶于水 | C. | 干冰汽化 | D. | 加热分解氯化铵 |
10.下列说法正确的是( )
| A. | 煤经分馏得到了煤焦油,从中可分离出苯、甲苯、二甲苯等有机化合物 | |
| B. | 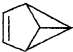 的一氯代物有3种 的一氯代物有3种 | |
| C. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| D. | 木糖醇(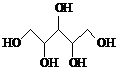 )和葡萄糖( )和葡萄糖(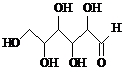 ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
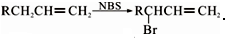 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: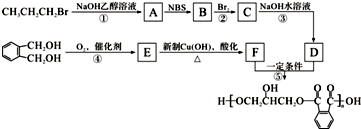
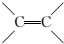 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.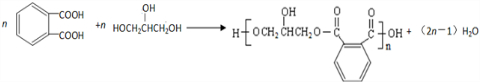 .
.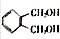 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.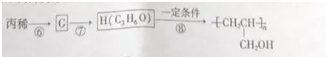
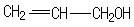 .
.