题目内容
6.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.
.元素⑩名称为溴,在周期表中的位置是第四周期ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(3)这些元素中能形成两性氢氧化物的元素是铝(填名称),写出该元素的氢氧化物与④的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)元素①、②的最简单氢化物的稳定性:H2O大于NH3.(填写氢化物的分子式)
(5)请设计一个实验方案,比较⑥、⑦单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
分析 由元素在周期表中的位置可知,①为N、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
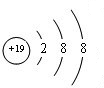
(1)Ar元素原子最外层为稳定结构,最不活泼;上述元素中K的金属性最强,质子数为19,离子核外电子数为18,有3个电子层,各层电子数为2、8、8;⑩为Br,由其位置可知处于第四周期ⅦA族;
(2)最高价氧化物的水化物中,酸性最强是高氯酸;
(3)氢氧化铝是两性氢氧化物,与去氢氧化钠反应生成偏铝酸钠与水;
(4)非金属性越强,氢化物越稳定;
(5)利用元素单质之间的相互置换反应进行验证.
解答 解:由元素在周期表中的位置可知,①为N、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)Ar元素原子最外层为稳定结构,化学性质最不活泼;上述元素中K的金属性最强,质子数为19,离子核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为 ;⑩为Br,名称为溴,由其位置可知处于第四周期ⅦA族,
;⑩为Br,名称为溴,由其位置可知处于第四周期ⅦA族,
故答案为:Ar;K; ;溴;第四周期ⅦA族;
;溴;第四周期ⅦA族;
(2)最高价氧化物的水化物中,酸性最强是高氯酸,其化学式为HClO4,故答案为:HClO4;
(3)Al元素的最高价氧化物的水化物--氢氧化铝,是两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:铝;Al(OH)3+OH-=AlO2-+2H2O;
(4)非金属性O>N,非金属性越强,氢化物越稳定,故氢化物稳定性:H2O>NH3,
故答案为:H2O>NH3;
(5)利用元素单质之间的相互置换反应进行验证,具体方案为:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强,
故答案为:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
点评 本题考查元素周期表与元素周期律,关键是要有一个完整准确的元素周期表准确判断元素,(5)中题目设计实验虽然简单,但体现了新课标的要求.

 阅读快车系列答案
阅读快车系列答案| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是c>b>a>d | |
| B. | c的氢化物比a的氢化物稳定 | |
| C. | b和d可结合成bd32-和bd42-阴离子 | |
| D. | a、b、c的最高价氧化物对应水化物的酸性强弱关系是c>b>a |
| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
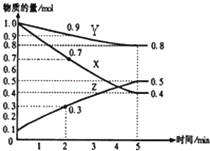
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
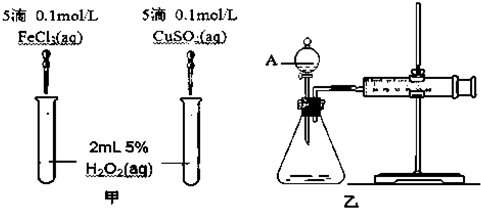
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
| A. | Na、Li | B. | N、Cl | C. | Si、S | D. | O、P |
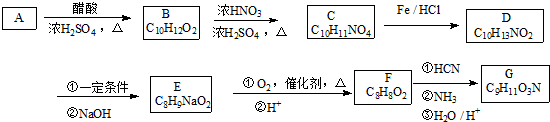
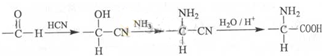
 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O.
+H2O.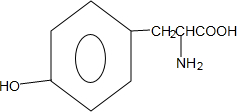 .
.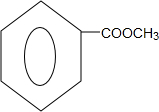 .
.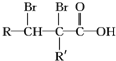 ,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).
,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).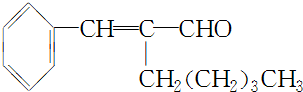 .
.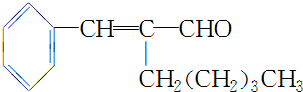 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH
 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.