题目内容
19.(1)表中的实线表示元素周期表部分边界,请用实线画出周期表上边界及金属元素与非金属元素的分界线.
(2)把符合下列要求的元素的元素符号标在表中对应位置处.
①最高价氧化物的水化物碱性最强(放射性元素除外)
②气态氢化物最稳定的非金属元素
(3)主族元素在元素周期表中的位置与元素原子结构的关系周期数=电子层数,主族族序数=最外层电子数.
分析 (1)第周期容纳2种元素,分别处于第1、18列,二、三周期中ⅡA、ⅢA分别处于2、13列;第一周期均为非金属性,其它周期中,元素原子电子层>最外层电子数为非金属性元素,其余为金属元素;
(2)①最高价氧化物的水化物碱性最强,在元素周期表左下方,放射性元素除外就是金属性最强的 Cs,位于第六周期IA族;
②非金属性越强对应气态氢化物最稳定的越强,在元素周期表的右上方对应的元素是氟,位于第二周期、17列;
(3)对主族元素周期数=电子层数、主族族序数=最外层电子数.
解答 解:(1)第一周期只有2种元素,分别处于第1、18列,二、三周期中ⅡA、ⅢA分别处于2、13列;第一周期均为非金属,金属与非金属的分界线除ⅠA在氢元素下侧,其他各族元素皆处于周期数=主族数的元素的上侧和右侧,用实线画出元素周期表的上边界,且用实线标出金属元素与非金属元素的分界线为: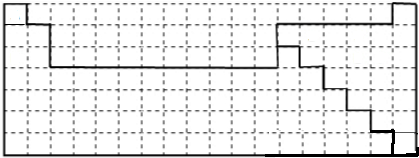 ,
,
故答案为 ;
;
(2)①最高价氧化物的水化物碱性最强,在元素周期表左下方,放射性元素除外就是金属性最强的 Cs,位于第六周期IA族;
②非金属性越强对应气态氢化物最稳定的越强,在元素周期表的右上方对应的元素是氟,位于第二周期、17列,
在周期中的位置为: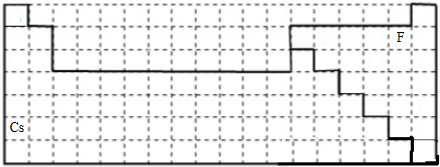 ,
,
故答案为: ;
;
(3)对主族元素,周期数=电子层数、主族族序数=最外层电子数,故答案为:周期数=电子层数;主族族序数=最外层电子数.
点评 本题考查元素周期表、元素周期律、结构与位置关系,比较基础,注意对元素周期表的整体把握.

练习册系列答案
相关题目
18.100g样品所消耗的溴的毫克数称为溴指数.溴指数越高,则说明样品中不饱和烃含量越高.我国石油工业一般利用恒定电流库仑分析法测定汽油的溴指数,利用电解产生的溴与不饱和烃反应,支持电解质为LiBr,溶剂仅含5%的水,其余为甲醇,苯与醋酸.下列有关说法正确的是( )
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
14.KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述正确的是( )
| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |
4.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
11.下列各组元素中,属于同一周期的是( )
| A. | Na、Li | B. | N、Cl | C. | Si、S | D. | O、P |
8.下列石油和煤的炼制和加工过程中,不属于化学变化的是( )
| A. | 分馏 | B. | 干馏 | C. | 裂化 | D. | 裂解 |
 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又