16.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”.下列说法不正确的是 ( )
| A. | 石油和天然气都属于碳素燃料 | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 目前研究菠菜蛋白质“发电”不属于“太阳能文明” |
15.CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂.工业上用粗制的氧化铜粉末(含FeO和SiO2杂质)来制取无色CuCl2的流程如下: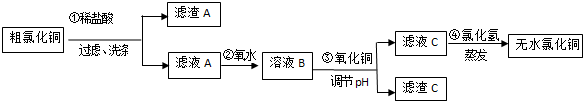
已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
(1)第②步反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
14.下列工业生产过程中涉及到反应热再利用的是( )
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
13.炭的化合物有着相当广泛的用途.请回答下列问题:
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率:v(CH3OH)=0.03mol/(L.min);
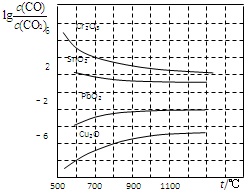
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知;
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1
(2)以 CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=nCO2+4nH+
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:CO(g)+2H2(g)?CH3OH(g)
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为80%.
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160,
此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.800℃时,其中最易被还原的金属氧化物是Cu2O(填化学式),该反应的平衡常数数值(K)等于106.

9.25℃,有v1mLpH≈9的氨水(A)和v2mLpH≈10的氨水(B),v3mLpH=10的NaOH溶液(C),它们能中和同量的盐酸,以下叙述正确的是( )
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2≈v3 | |
| D. | 中和热A=B=C |
8.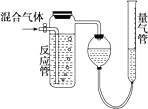 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
7.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:5HClO2→4ClO2↑+H++Cl-+2H2O.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
0 167623 167631 167637 167641 167647 167649 167653 167659 167661 167667 167673 167677 167679 167683 167689 167691 167697 167701 167703 167707 167709 167713 167715 167717 167718 167719 167721 167722 167723 167725 167727 167731 167733 167737 167739 167743 167749 167751 167757 167761 167763 167767 167773 167779 167781 167787 167791 167793 167799 167803 167809 167817 203614
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |