题目内容
12.南美洲干旱地区有智利硝石,是制取炸药的重要原料,其主要成分是NaNO3,还含少量NaIO3等可溶盐和不容物.NaNO3溶于水时溶液的温度降低.(1)以下操作可从智利硝石分理出NaNO3:溶解、过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(2)用NaNO3和浓硫酸反应可以制取硝酸,反应的化学方程式为NaNO3+H2SO4$\frac{\underline{\;微热\;}}{\;}$NaHSO4+2HNO3↑;热的硝酸会腐蚀橡胶,制取装置中应该用磨砂接口代替胶管和胶塞.
(3)智利硝石资源有限(曾引起过南太平洋战争),现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有(请结合课本知识回答)合成氨、制硝酸、氯碱工业等;写出工业制硝酸的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3.
分析 (1)智利硝石其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物,从智利硝石分离出NaNO3,的实验步骤为溶解过滤除去不溶性杂质,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥分离得到较纯净的硝酸钠;
(2)用NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,硝酸具有氢氧化性能氧化橡胶;
(3)现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮已化为二氧化氮,二氧化氮溶于水生成硝酸,为充分吸收通入水中的氧气和一氧化氮体积比为3:4.
解答 解:(1)智利硝石其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物,从智利硝石分离出NaNO3,的实验步骤为溶解过滤除去不溶性杂质,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥分离得到较纯净的硝酸钠,
故答案为:过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(2)用NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,反应的化学方程式为:NaNO3+H2SO4=NaHSO4+2HNO3↑,硝酸具有氢氧化性能氧化橡胶,热的硝酸会腐蚀橡胶,制取装置中应该用磨砂接口代替胶管和胶塞,
故答案为:NaNO3+H2SO4$\frac{\underline{\;微热\;}}{\;}$NaHSO4+2HNO3↑;磨砂接口;
(3)现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸,为充分吸收通入水中的氧气和一氧化氮体积比为3:4,工业制硝酸的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3;
故答案为:合成氨;氯碱工业;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;4NO+3O2+2H2O=4HNO3.
点评 本题考查了氮及其化合物性质的分析应用,题目难度中等,涉及化学实验基本操作、物质分离提纯、氧化还原反应的实质理解应用,掌握基础知识为解题关键.

①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
| A. | Na+→Na | B. | Cl→Cl- | C. | H+Cl→HCl | D. | H2→H+H |
| A. | 同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 | |
| B. | 同主族元素随原子序数递增,单质氧化能力逐渐增强 | |
| C. | 同主族元素原子最外层电子数都相同 | |
| D. | 同主族元素的原子半径,随原子序数增大而逐渐增大 |
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
| A. | NaCl | B. | MgBr2 | C. | CaCl2 | D. | K2O |
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
 CO2
CO2
 Cl
Cl .
.
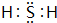 .
.