题目内容
7.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:5HClO2→4ClO2↑+H++Cl-+2H2O.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始反应缓慢,稍后产生气体速度较快,速度变化的原因是( )| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
分析 A.ClO2逸出,反应速率减小;
B.如果是氢离子浓度改变反应速率,则pH相同的盐酸和硫酸影响反应速率相同;
C.开始时溶液中就有氢离子,反应速率很慢;
D.开始时溶液中氯离子浓度很小,随着反应进行,氯离子浓度逐渐增大.
解答 解:A.ClO2逸出,反应速率减小,而稍后-段时间产生气体速度较快,则说明不是逸出ClO2的原因,故A错误;
B.如果是氢离子浓度改变反应速率,则pH相同的盐酸和硫酸影响反应速率相同,与题给信息不符合,所以不是氢离子使分解速率加快,故B错误;
C.由于开始时溶液中就有氢离子,分解反应却非常慢,可见氢离子不起催化作用,故C错误;
D.反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,故D正确.
故选D.
点评 本题考查化学反应速率的影响因素,侧重考查催化剂对化学反应速率的影响,正确获取信息、利用信息解答问题是解本题关键,题目难度中等.

练习册系列答案
相关题目
8.下列反应的有机产物中只有一种的是( )
| A. | CH3CH═CH2与HCl加成 | B. | CH3CH2CH2Cl在碱性溶液中水解 | ||
| C. | CH3CH2OH与浓H2SO4混合加热 | D. | CH3CHBrCH2CH3与NaOH醇溶液共热 |
5.下列化学用语正确的是( )
| A. | 氯化氢的电子式: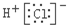 | B. | N2的结构式:N≡N | ||
| C. | 硫离子结构示意图: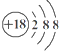 | D. | 四氯化碳的电子式: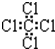 |
19.某阴离子X2-有m个电子,其质量数为a,则核内中子数为( )
| A. | m+2 | B. | m+5 | C. | a-m+2 | D. | a-m-2 |
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO3- | |
| B. | 无色溶液中:K+、Ca2+、Cl-、NO3- | |
| C. | 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3- | |
| D. | 使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4- |
17.对下列事实的解释不正确的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 反应CuSO4+H2S=CuS↓+H2SO4,说明硫化铜既不溶于水,也不溶于稀硫酸 | |
| C. | 常温下浓硫酸、浓硝酸可以用铝罐储存,说明浓硫酸、浓硝酸与铝不反应 | |
| D. | 漂白粉长期放置在空气中会失效,说明其主要成分与空气中的某成分发生了反应 |
 .
. .
.
