题目内容
9.25℃,有v1mLpH≈9的氨水(A)和v2mLpH≈10的氨水(B),v3mLpH=10的NaOH溶液(C),它们能中和同量的盐酸,以下叙述正确的是( )| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2≈v3 | |
| D. | 中和热A=B=C |
分析 一水合氨为弱碱,同等pH值的氨水溶液与氢氧化钠溶液,氨水的浓度要比氢氧化钠大,据此解答即可.
解答 解:一水合氨为弱碱,同等pH值的氨水溶液与氢氧化钠溶液,氨水的浓度要比氢氧化钠大,
A、氨水浓度越小,电离程度越大,故A和B能中和同量的盐酸时,消耗A的体积>B的10倍,故A正确;
B、加入少量水稀释,氨水电离程度增大,但是碱性减弱,故氢氧根浓度减小,温度不变,故:$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不变,氢氧根浓度减小,故$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大,故B错误;
C、由于一水合氨是弱碱,故随着反应的进行继续电离出氢氧根,故v2<v3,故C错误;
D、中和热的定义为:稀的强酸与稀的强碱反应生成1mol水放出的热量,由于一水合氨是弱碱,故电离需要吸热,故反应热ABC不同,故D错误,
故选A.
点评 本题主要考查的是弱碱的电离以及影响其电离的因素等,难度较大,注意分析溶液中各种离子的浓度变化是关键.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
9.下列物质中所含有的化学键类型完全相同的一组是( )
| A. | KCl、NaOH | B. | CO2、HCl | C. | CaCl2、NH4NO3 | D. | Na2O2、H2O2 |
7.现对卤素单质Cl2,Br2,I2的氧化性强弱进行探究,从而总结出在元素周期表中,同一主族元素非金属性变化规律.完成下列表格并得出结论
结论:(1)卤素单质Cl2,Br2,I2的氧化性由强到弱的顺序Cl2>Br2>I2
(2)同一主族元素从上到下非金属性逐渐减弱.
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
(2)同一主族元素从上到下非金属性逐渐减弱.
4.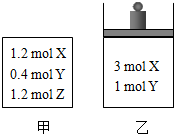 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )| 恒容容器甲 | 恒压容器乙 | |
| Y的物质的量/mol | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前大 | |
| B. | 平衡时容器甲的压强一定比反应前大 | |
| C. | n2>n1 | |
| D. | φ2>φ1 |
14.下列工业生产过程中涉及到反应热再利用的是( )
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
1.X、Y、Z三种元素都是短周期元素,在元素周期表中位置如图,X和Z原子核内的质子数之和等于Y原子核内质子数,下列推断正确的是( )
| X | Z | |
| Y |
| A. | 原子半径:X>Y>Z | B. | 气态氢化物稳定性:X<Y<Z | ||
| C. | 元素的非金属性强弱:Y<X<Z | D. | Y和Z形成的是分子晶体 |
18.下列选项中的数值前者小于后者的是( )
| A. | 25℃和l00℃时H2O的KW | |
| B. | 同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) | |
| C. | 同温同浓度的NaHCO3溶液和CH3COONa溶液的pH | |
| D. | 中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
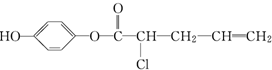 ,其不可能发生的反应有( )
,其不可能发生的反应有( )