4.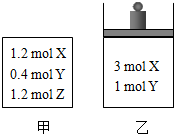 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )| 恒容容器甲 | 恒压容器乙 | |
| Y的物质的量/mol | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前大 | |
| B. | 平衡时容器甲的压强一定比反应前大 | |
| C. | n2>n1 | |
| D. | φ2>φ1 |
1.聚合硫酸铁(PFS)是一种重要的无机高分子絮凝剂,在工业和生活污水处理等领域具有重要应用.PFS可表示成Fex(OH)y(SO4)z(其中铁元素化合价为+3),工业上常用绿矾等原料制备,采用“一锅法”制备PFS的工艺流程如下.
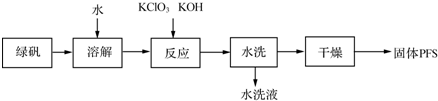
(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
试分析“一锅法”工艺的优点是未使用硫酸,不腐蚀设备,选择表中的一种方案分析其可能的缺点双氧水法:反应放热,双氧水分解(或次氯酸钠法:产生氯气,污染环境或硝酸氧化法:产生NO2等氮氧化物污染环境).
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.

(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.
10.下列关于同主族元素的说法错误的是( )
| A. | 同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 | |
| B. | 同主族元素随原子序数递增,单质氧化能力逐渐增强 | |
| C. | 同主族元素原子最外层电子数都相同 | |
| D. | 同主族元素的原子半径,随原子序数增大而逐渐增大 |
7.现对卤素单质Cl2,Br2,I2的氧化性强弱进行探究,从而总结出在元素周期表中,同一主族元素非金属性变化规律.完成下列表格并得出结论
结论:(1)卤素单质Cl2,Br2,I2的氧化性由强到弱的顺序Cl2>Br2>I2
(2)同一主族元素从上到下非金属性逐渐减弱.
0 167622 167630 167636 167640 167646 167648 167652 167658 167660 167666 167672 167676 167678 167682 167688 167690 167696 167700 167702 167706 167708 167712 167714 167716 167717 167718 167720 167721 167722 167724 167726 167730 167732 167736 167738 167742 167748 167750 167756 167760 167762 167766 167772 167778 167780 167786 167790 167792 167798 167802 167808 167816 203614
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
(2)同一主族元素从上到下非金属性逐渐减弱.
 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
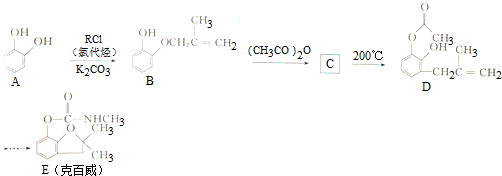
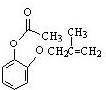 .
.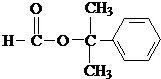 .
.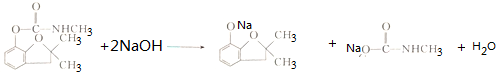 .
. 的两步化学方程式
的两步化学方程式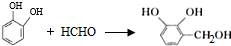 、
、 .
.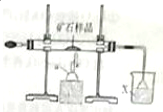 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:


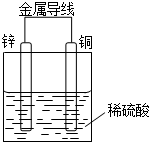 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告