题目内容
9.新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn或Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去.转化流程如图所示:
(1)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于胶体.
(2)写出MFe2Ox分解SO2的化学方程式MFe2Ox+4−x2SO2=MFe2O4+4−x2S
(3)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2:1,则还原产物MFe2Ox中x=3.5,MFe2Ox中+2价铁与+3价铁的物质的量之比为1:1.
(4)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+═2Fe2++4H2O,有K2MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平:Fe2CO42-+Cu2O+10H+=2Fe2++2Cu2++5H2O.
分析 (1)纳米材料氧缺位铁酸盐微粒直径达到胶体微粒直径;
(2)由示意图可知MFe2Ox与SO2反应,生成MFe2O4,SO2被还原,应生成S;
(3)反应的方程式为2MFe2O4+H2=2MFe2Ox+H2O,根据质量守恒确定x的值;计算Fe元素平均化合价,进而计算+2价铁与+3价铁的物质的量之比;
(4)Fe2O42-+2e-+8H+→2Fe2++4H2O为还原反应,则应加入还原性物质,只有Cu2O符合.
解答 解:(1)纳米材料氧缺位铁酸盐微粒直径达到胶体微粒直径,分散在蒸馏水中,所形成的分散系属于胶体,
故答案为:胶体;
(2)由示意图可知MFe2Ox与SO2反应,生成MFe2O4,SO2被还原,应生成S,反应可表示为:MFe2Ox+4−x2SO2=MFe2O4+4−x2S,故答案为:MFe2Ox+4−x2SO2=MFe2O4+4−x2S;
(3)反应的方程式为:2MFe2O4+H2=2MFe2Ox+H2O,由质量守恒可知2x+1=2×4,解得x=3.5,则MFe2O3.5中,Fe元素的化合价为 2×3.5−22=2.5,则MFe2Ox中+2价铁与+3价铁的量之比为1:1,
故答案为:3.5;1:1;
(4)Fe2O42-+2e-+8H+→2Fe2++4H2O为还原反应,则应加入还原性物质,只有Cu2O符合,反应的化学方程式为:Fe2CO42-+Cu2O+10H+=2Fe2++2Cu2++5H2O,
故答案为:Fe2CO42-+Cu2O+10H+=2Fe2++2Cu2++5H2O.
点评 本题综合考查氧化还原反应知识等,侧重于学生的分析能力和计算能力的考查,注意理解题目信息从元素化合价的角度解答该题,难度不大.

练习册系列答案
相关题目
19.下列四个选项是在不同的情况下对化学反应A(g)+3B(g)?2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
| A. | v(D)=0.5mol•L-1•min-1 | B. | v(C)=0.40 mol•L-1•min-1 | ||
| C. | v(B)=0.45 mol•L-1•s-1 | D. | v(A)=0.3mol•L-1•s-1 |
20.下列各组微粒中,互为同素异形体的是( )
| A. | 126C和136C | B. | H2O和D2O | ||
| C. | O2与O3 | D. | CH3OCH3与CH3CH2OH |
17.下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量NaOH溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
①向饱和碳酸钠溶液中通入过量的CO2;
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量NaOH溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ①③ |
4.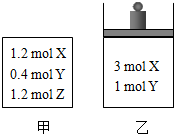 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )| 恒容容器甲 | 恒压容器乙 | |
| Y的物质的量/mol | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前大 | |
| B. | 平衡时容器甲的压强一定比反应前大 | |
| C. | n2>n1 | |
| D. | φ2>φ1 |
9. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 | |
| B. | 由于键能H-R>H-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 最高价氧化物对应的水化物的酸性:X<T<Q |
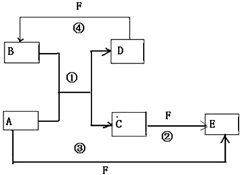 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)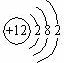 .反应④的化学方程式为C+4HNO3(浓)
.反应④的化学方程式为C+4HNO3(浓)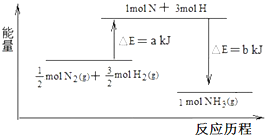 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.