题目内容
3.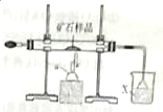 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:(1)写出硬质玻璃管中发生反应的化学方程式Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑
(2)仪器a的名称为酒精喷灯,倒置漏斗的作用为防止倒吸;
(3)若X为氯化钡溶液,则实验未见白色沉淀生成,再向该烧杯中加入足量ac(填字母),就能看到产生白色沉淀.
a.氨水 b.稀盐酸 c.硝酸钾溶液 d.硫化钠溶液
(4)为了测定矿石样品中Cu2S的质量分数,反应开始前称取研细的铜矿样品25.00g,假定铜矿中的硫全部转化为SO2,其他杂质不参与反应,反应后鼓入一定氦气使装置中SO2全部被水吸收,并配成250mL溶液.
移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.10mol/LKMnO4标准溶液滴定至终点,按上述操作重复滴定2次,平均消耗标准溶液19.95mL.
则滴定过程中发生反应的化学方程式为5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4,当无色变为紫红色时判断滴定已经达到终点,铜矿样品中Cu2S的质量分数是31.92%
(5)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误)你认为是配制SO2的水溶液没有考虑空气中的O2对SO2的影响,发生反应:2SO2+O2+2H2O=2H2SO4.
分析 (1)由题目信息及问题(4)可知Cu2S、Cu2O在加热条件下得到Cu,反应还得到SO2;
(2)仪器a为酒精喷灯;二氧化硫会污染环境,需要进行吸收,防止装置内压强降低而发生倒吸;
(3)加入碱性溶液,吸收二氧化硫得到亚硫酸盐;或加热强氧化性物质,将亚硫酸氧化为硫酸;
(4)高锰酸钾溶液具有强氧化性,发生反应:5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4,滴入的最后一滴高锰酸钾溶液颜色不褪去,二氧化硫反应完毕时,滴定到达终点,根据方程式计算250mL溶液中n(SO2),进而计算25mL溶液中二氧化硫的物质的量,根据硫元素守恒计算n(Cu2S),再根据m=nM计算m(Cu2S),进而计算矿石中Cu2S的质量分数;
(5)配制SO2的水溶液没有考虑空气中的O2对SO2的影响.
解答 解:(1)由题目信息及问题(4)可知Cu2S、Cu2O在加热条件下得到Cu,反应还得到SO2,反应方程式为:Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑,
故答案为:Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑;
(2)仪器a为酒精喷灯;二氧化硫会污染环境,需要进行吸收,使用倒置漏斗防止装置内压强降低而发生倒吸,
故答案为:酒精喷灯;防止倒吸;
(3)a.氨水与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应得到亚硫酸钡沉淀,故a符合;
b.酸性条件下,亚硫酸钡不能沉淀,故b错误;
c.加入硝酸钾溶液,酸性条件下,可以将亚硫酸氧化为硫酸,反应得到硫酸钡沉淀,故b符合;
d.硫化钠溶液,酸性条件下可以得到硫淡黄色沉淀,故d不符合,
故选:ac;
(4)高锰酸钾溶液具有强氧化性,发生反应:5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4,滴入的最后一滴高锰酸钾溶液颜色不褪去,二氧化硫反应完毕时,此时无色变为紫红色,滴定到达终点;
25mL溶液中n(SO2)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×19.95×10-3L×0.1mol/L,则250mL溶液中n(SO2)=$\frac{5}{2}$n(KMnO4)=($\frac{5}{2}$×19.95×10-3L×0.1mol/L)×$\frac{250mL}{25mL}$,
由S元素守恒可知,n(Cu2S)=($\frac{5}{2}$×19.95×10-3L×0.1mol/L)×$\frac{250mL}{25mL}$,故m(Cu2S)=($\frac{5}{2}$×19.95×10-3L×0.1mol/L)×$\frac{250mL}{25mL}$×160g/mol=7.98g,
铜矿样品中Cu2S的质量分数是$\frac{7.98g}{25.00g}$×100%=31.92%,
故答案为:5SO2+2KMnO4+2H2O=2H2SO4+K2SO4+2MnSO4;无色变为紫红色;31.92%;
(5)配制SO2的水溶液,空气中氧气与二氧化硫发生反应:2SO2+O2+2H2O=2H2SO4,会导致测定的二氧化硫的量偏小,最终导致沉淀Cu2S的含量偏低,
故答案为:配制SO2的水溶液没有考虑空气中的O2对SO2的影响,发生反应:2SO2+O2+2H2O=2H2SO4.
点评 本题考查实验方案评价、物质含量的测定等,明确原理是解题关键,是对学生综合能力的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
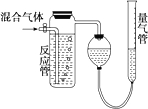 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
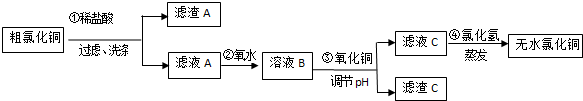
已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
| A. | B. | C. | D. |
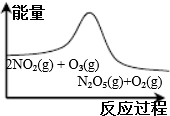 | 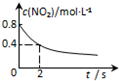 | 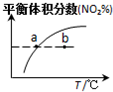 | 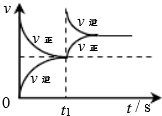 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
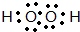 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为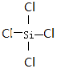 .
.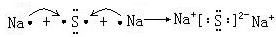 ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.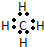 ,CaCl2
,CaCl2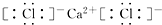 ,NaOH
,NaOH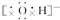 Na2O2
Na2O2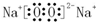 .
.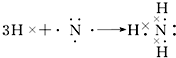 ;
; .
.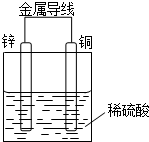 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告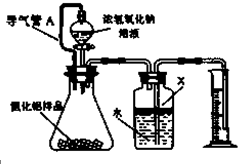 氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知: