题目内容
2.某化学兴趣小组试利用镁铝合金废料制备硫酸铝晶体,并对硫酸铝晶体进行热重分析,其实验流程如下: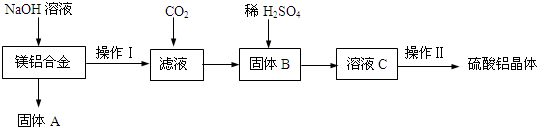
(1)在镁铝合金中加入NaOH溶液,发生反应的化学反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,固体B的化学式Al(OH)3.
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是可以减少晶体的溶解,有利于晶体的干燥.
(4)若初始时称取的镁铝合金废料的质量为9.00g,得到固体A的质量为4.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质).计算得硫酸铝晶体的化学式为Al2(SO4)3.18H2O.
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K~523K,553K~687K,当温度在1043K以上不再失重,其热分解的TG曲线见图,
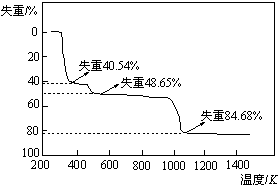
已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%
根据图示数据计算确定每步分解的产物,写出:
①失重第一阶段分解产物的化学式Al2(SO4)3.3H2O,
②失重第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
分析 向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,镁不反应,固体A为Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,发生反应:NaAlO2+CO2+2H2O═Al(OH)3
↓+NaHCO3,再通过过量进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体;
(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠,镁不反应;
(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;
(3)用乙醇洗涤,可以减少晶体的溶解,有利于晶体的干燥;
(4)Al的质量为9g-4.95g=4.05g,设硫酸铝晶体化学式为:Al2(SO4)3.nH2O,根据Al元素守恒计算硫酸铝晶体的物质的量,再计算硫酸铝晶体的相对分子质量,进而计算n的值,确定化学式;
(5)根据(4)中计算可知,晶体中结晶水的质量分数,低温加热,首先失去结晶水,高温下,最终硫酸铝分解,根据失重%计算判断各阶段分解产物,再书写化学方程式.
解答 解:向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,镁不反应,固体A为Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,发生反应:NaAlO2+CO2+2H2O═Al(OH)3
↓+NaHCO3,再通过过量进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体;
(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠与氢气,镁不反应,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由上述分析可知,固体B为Al(OH)3,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;Al(OH)3;
(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,
故答案为:冷却结晶、过滤;
(3)用乙醇洗涤,可以减少晶体的溶解,有利于晶体的干燥,
故答案为:可以减少晶体的溶解,有利于晶体的干燥;
(4)Al的质量为9g-4.95g=4.05g,其物质的量为$\frac{4.05g}{27g/mol}$=0.15mol,设硫酸铝晶体化学式为:Al2(SO4)3.nH2O,根据Al元素守恒,硫酸铝晶体的物质的量为$\frac{0.15mol}{2}$=0.075mol,故硫酸铝晶体的相对分子质量为$\frac{49.95}{0.075}$=666,则54+96×3+18n=666,解得n=18,故该硫酸铝晶体的化学式为:Al2(SO4)3.18H2O,
故答案为:Al2(SO4)3.18H2O;
(5)晶体中结晶水的含量为$\frac{18×18}{666}$=48.65%,故第二阶段完全失去结晶水,得到物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为$\frac{666×40.54%}{18}$=15,故第一阶段得到的物质为Al2(SO4)3.3H2O,
第三阶段剩余物质的相对分子质量为666×(1-84.68%)=102,应是Al2O3,故硫酸铝反应生成氧化铝与三氧化硫,反应方程式为:Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑,
故答案为:Al2(SO4)3.3H2O;Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
点评 本题考查实验制备方案、物质分离提纯、方案分析评价、物质组成测定等,是对学生综合能力的考查,注意(5)中充分利用硫酸铝晶体相对分子质量进行计算解答,难度中等.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案| A. | Y元素为Na元素 | B. | X只能位于第3周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第2周期 |
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中化学键类型完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | M的气态氢化物比N的气态氢化物稳定 |
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是 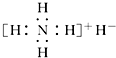 | |
| C. | 与水反应时,它既是还原剂又是氧化剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
(2)同一主族元素从上到下非金属性逐渐减弱.
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
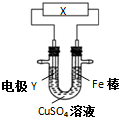
| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42- 移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |