12.碳及其化合物在生产生活中的应用比较广泛,回答下列问题:
(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
实验1条件下平衡常数K=0.25,a、b之间可能的关系为b=2a+1.
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示: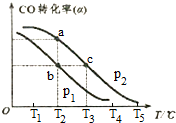
①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)
(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:

①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)
11.某白色固体可能由①NH4Cl、②AlCl3、③KCl、④AgNO3、⑤NaOH中的一种或几种组成,此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀产生.则对原固体的判断不正确的是( )
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 无法确定是否有③ | D. | 至少存在①、④、⑤ |
10.实验室用溴化钠、浓硫酸和醇制备溴乙烷(CH3CH2Br)和1-溴丁烷(CH3CH2CH2CH2Br)的反应原理如下:
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动,但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,1-溴丁烷在下层(“上层”“下层”或“不分层”)加入NaHSO3溶液的目的是除去产物中杂质溴
(5)将实验(4)所得1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g、NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2位有效数字)
8.研究证明:CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的量百分数如图1所示:
请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
7. 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
( )
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
6.以CH2=CH2和CH2=CH-CH3混合物为单体,发生加聚反应,可能得到的是( )

0 167567 167575 167581 167585 167591 167593 167597 167603 167605 167611 167617 167621 167623 167627 167633 167635 167641 167645 167647 167651 167653 167657 167659 167661 167662 167663 167665 167666 167667 167669 167671 167675 167677 167681 167683 167687 167693 167695 167701 167705 167707 167711 167717 167723 167725 167731 167735 167737 167743 167747 167753 167761 203614

| A. | ①② | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④ |




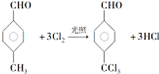 ,反应类型为取代反应
,反应类型为取代反应 +n
+n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +(2n-1)H2O
+(2n-1)H2O 的路线流程图:
的路线流程图: 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.