题目内容
3.甲烷化技术是煤制天然气最核心、最关键的技术.CO加氢合成甲烷属于多相催化平衡反应,催化剂一般为镶催化剂(工作温度400K-800K),主反应式:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ/mol (1)
CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165kJ/mol (2)
(1)煤经过气化、变换、净化得到的合成气中一般含有H2、CO、CO2、H2O和惰性气体.
①请写出H2O(g)与CO反应的热化学反应方程式CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol.(该反应编号为“(3)”).
②若主反应(1)(2)的平衡常数450K时分别为K1、K2,则与“H2O与CO反应的平衡常数K3(同温度)”的数量关系为$\frac{K{\;}_{1}}{K{\;}_{2}}$.
(2)在体积不变的容器中,进行甲烷化反应,若温度升高,CO和H2的转化率都降低(填“降低”、“升高”或“不变”),但数据显示CO转化率变化更为显著,主要原因是
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.(3)当温度在800K以上时,平衡体系中还会有下列2个副反应:
2CO(g)=C(g)+CO2(g)△H=-171kJ/mol (快反应) (4)
C(s)+2H2(g)=CH4(g)△H=-73kJ/mol(慢反应) (5)
甲烷化反应容器就会出现碳固体结块现象,热量传递不好而使催化剂烧结,失去催化作用.
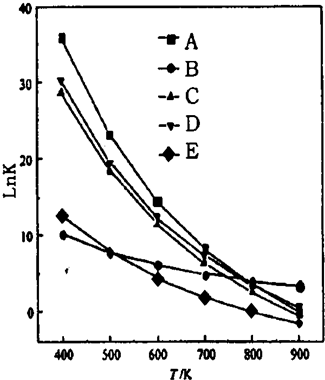
(4)甲烷化反应容器主副反应(1)至(5),其平衡常数K的对数lnK与温度关系如图:写出图中曲线A、B所对应的反应方程式编号(1)(3).
分析 (1)①已知:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ/mol (1)
CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165kJ/mol (2)
利用盖斯定律将(1)-(2)书写计算;
②利用盖斯定律结合平衡常数K3=$\frac{c(H{\;}_{2})c(CO{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$计算;
(2)根据甲烷化反应都为放热反应,温度升高,平衡向逆方向移动,则CO和H2的转化率都降低;又根据CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol 温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低;
(3)根据C(s)+2H2(g)=CH4(g)△H=-73kJ/mol(慢反应) (5),反应慢,所以反应过程中会出现碳过剩,热量传递不好而使催化剂烧结,失去催化作用;
(4)由图象作等温线 ,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),据此分析.
,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),据此分析.
解答 解:(1)①已知:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ/mol (1)
CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165kJ/mol (2)
利用盖斯定律将(1)-(2)可得:CO(g)+H2O(g)=CO2(g)+H2(g)△H=(-206+165)KJ/mol=-41kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;
②K3=$\frac{c(H{\;}_{2})c(CO{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$=$\frac{\frac{c(CH{\;}_{4})c(H{\;}_{2}O)}{c(CO)c{\;}^{3}(H{\;}_{2})}}{\frac{c(CH{\;}_{4})c{\;}^{2}(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{4}(H{\;}_{2})}}$=$\frac{K{\;}_{1}}{K{\;}_{2}}$;故答案为:$\frac{K{\;}_{1}}{K{\;}_{2}}$;
(2)因为甲烷化反应都为放热反应,温度升高,平衡向逆方向移动,则CO和H2的转化率都降低;又根据CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低,
故答案为:降低;CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低;
(3)因为2个副反应2CO(g)=C(g)+CO2(g)△H=-171kJ/mol (快反应) (4)C(s)+2H2(g)=CH4(g)△H=-73kJ/mol(慢反应) (5),而(4)快(5)慢,所以反应过程中会出现碳固体结块现象,热量传递不好而使催化剂烧结,失去催化作用,故答案为:碳固体结块;
(4)由图象作等温线 ,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),所以曲线A、B所对应的反应方程式编号为(1)(3),故答案为:(1)(3).
,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),所以曲线A、B所对应的反应方程式编号为(1)(3),故答案为:(1)(3).
点评 本题主要考查了盖斯定律的应用,平衡移动原理及其平衡常数之间的关系,难度较大,注意图象信息的提取与应用.

| A. | 钾的密度比钠的小 | B. | 加热时,钾比钠更易气化 | ||
| C. | 钾与水反应比钠与水反应更剧烈 | D. | 钾原子的电子层比钠原子多一层 |
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
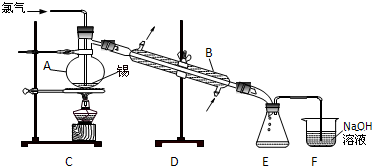 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.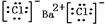 ,⑤的形成过程用电子式表示为
,⑤的形成过程用电子式表示为 .
.