题目内容
7. 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
分析 A.当没有加入氢氧化钠溶液时,0.1mol/LH2A溶液的pH>3,说明H2A为弱酸;
B.根据H2A的第一步电离平衡常数可知:$\frac{c(H{A}^{-})}{c({H}_{2}A)}$=$\frac{{K}_{a1}({H}_{2}A)}{c({H}^{+})}$,所以该比值随着溶液中的氢离子浓度的减小而增大;
C.V[NaOH(aq)]=20mL时,二者恰好反应生成NaHA,根据该溶液中的物料守恒判断;
D.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A═NaHA+H2O,溶液主要为NaHA,HA-的电离程度大于其水解程度,溶液显酸性.
解答 解:A.结合图象可知,氢氧化钠溶液体积为0时,0.1mol/LH2A溶液的pH>3,说明H2A在溶液中不能电离,属于弱酸,故A错误;
B.由电离平衡常数可知:$\frac{c(H{A}^{-})}{c({H}_{2}A)}$=$\frac{{K}_{a1}({H}_{2}A)}{c({H}^{+})}$,氢离子浓度与该比值成反比,随着氢氧化钠溶液体积增大,溶液中氢离子浓度逐渐减小,则该比值逐渐增大,故B正确;
C.V[NaOH(aq)]=20mL时,发生反应:NaOH+H2A═NaHA+H2O,溶质为NaHA,根据物料守恒可得:c(HA-)+c(A2-)+c(H2A )=c(Na+)=0.05mol/L,故C错误;
D.根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,水和HA-都电离出氢离子,只有HA-电离出A2-,所以离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理的概念及在判断离子浓度大小中的应用方法.

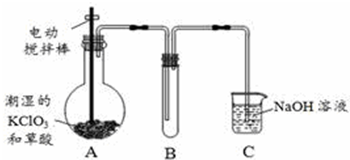
 阅读快车系列答案
阅读快车系列答案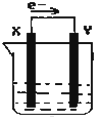 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列 关于该装置的说法正确的是( )| A. | 外电路电流方向为:X→外电路→Y | |
| B. | 若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两极都是金属,则它们的活动顺序为X>Y |
| A. | 乙烯能发生加成反应而乙烷不能 | |
| B. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
| A. | 氮气的电子式  | |
| B. | Mg2+的结构示意图  | |
| C. | NH3的结构式 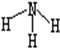 | |
| D. | 用电子式表示溴化氢的形成过程为: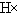 + +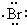 → →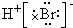 |
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向正极移动 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
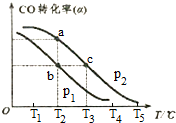
①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)

| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |
| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |