题目内容
12.碳及其化合物在生产生活中的应用比较广泛,回答下列问题:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
则CO2(g)+3H2(g)═CH2OH(l)+H2O(l)的反应热△H═-131.9KJ/mol;.
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)═CH3OH(l)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650℃ | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900℃ | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650℃ | 1.0 | 4.0 | 2.0 | a | b | c | t |
(3)已知CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
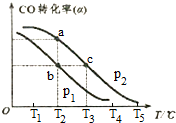
①p1<p2(填“<”、“>”或“═”),先升高温度,后增大压强,能否实现b点到c点的转化?能(填“能”或“不能”),原因是先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变.
②a、c两点的反应速率为v1<v2(填“<”、“>”或“═”)
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是:增大氢气浓度,增大压强、降低温度(答出三条措施)
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,①×3-②得到;
(2)结合化学平衡三段式列式计算平衡浓度
CO(g)+2H2(g)═CH3OH(l)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 2 0.5
K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
实验3温度不变,平衡常数不变,计算浓度商判断反应进行的方向,结合化学平衡三段式,起始量=消耗量+平衡量计算得到ab可能的关系;
(3)①该反应是反应前后气体体积减小的放热反应,相同温度下,增大压强,平衡向气体体积减小的方向移动,压强一定,升高温度,平衡逆向进行;
②ac点在曲线上压强相同,c点温度高于a点,反应速率大;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.
解答 解:(1):①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H1═-285.8KJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1═-725.5KJ•mol-1
依据盖斯定律①×3-②计算得到,CO2(g)+3H2(g)═CH2OH(l)+H2O(l)△H═-131.9KJ/mol,
故答案为:-131.9KJ/mol;
(2)结合化学平衡三段式列式计算平衡浓度,起始浓度,c(CO)=1mol/L,c(H2)=3mol/L
CO(g)+2H2(g)═CH3OH(l)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 2 0.5
K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.5}{0.5×{2}^{2}}$=0.25;
实验3温度不变,平衡常数不变,计算浓度商判断反应进行的方向,Q=$\frac{1}{0.5×{2}^{2}}$=0.5>K,反应正向进行
结合化学平衡三段式,
CO(g)+2H2(g)═CH3OH(l)
起始量(mol/L) 0.5 2 1
变化量(mol/L) c-1 2c-2 c-1
平衡量(mol/L) a b c
起始量=消耗量+平衡量,a+c-1=0.5,2c-2+b=2
得到b=2a+1,
故答案为:0.25,b=2a+1;
(3)①该反应是反应前后气体体积减小的放热反应,相同温度下,增大压强,平衡向气体体积减小的方向移动,平衡正向进行,一氧化碳转化率增大,压强越大一氧化碳转化率增大,P1<P2;压强一定,升高温度,平衡逆向进行,一氧化碳转化率减小,先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变,所以能实现b点到c点的转化,
故答案为:<,能,先升高温度,后增大压强,一氧化碳转化率先减小后增大,可以到达C点一氧化碳转化率不变;
②C点温度高反应速率快达到反应速率需要的时间短,V1<V2,故答案为:<;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇、增大氢气浓度等,故答案为:增大氢气浓度,增大压强、降低温度.
点评 本题考查了热化学方程式书写方法和盖斯定律的计算应用,化学平衡影响因素判断,图象分析判断,主要是化学平衡移动原理的应用,掌握基础是解题关键,题目难度中等.

(1)有机物X 的质谱图为: | (1)有机物X的相对分子质量是100. |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是 C5H8O2. |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3:1. | (3)有机物X的结构简式是 (CH3)2C(CHO)2. |
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
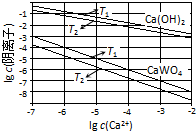 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).(1)图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远.50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol•L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42-的沉淀率为60%,计算实验测得的平衡常数.
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.

 ;
;