题目内容
9.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水.请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为第四周期第ⅤA族AsH3的稳定性比NH3的稳定性弱(填“强”或“弱”)
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为2H3AsO3+3S2-+6H+=As2S3+6H2O
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放.
①已知HCN为一元弱酸,则NaCN溶液的pH>7(填“>”“=”或“<”)
②处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式4H2O+2CN-+O2=2HCO3-+2NH3
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)①阳极的电机反应式为4OH--4e-═2H2O+O2↑
②简述浓缩室中得到浓乳酸的原理是阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大
③电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计.400mL.10g.L-1乳酸溶液通电一段时间后,浓度上升为145g.L-1(溶液体积变化忽略不计)阴极上产生的H2在标准状况下的体积约为6.72(乳酸的摩尔质量为90g.mol-1)
分析 (1)①根据电子层数=周期数,最外层电子数=族序数来回答;同主族,氰化物的稳定性从上到下逐渐减弱;
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷来书写方程式;
(2)①根据弱酸强碱盐水解导致溶液显示碱性来回答;
②根据信息:CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3来书写方程式;
(3)①根据电解池的工作原理:阳极上是阴离子氢氧根离子发生失电子的氧化反应来判断;
②根据电解池的工作原理:在电解池的阳极上是OH-放电,并且H+从阳极通过阳离子交换膜进入浓缩室;
③根据电极反应式结合原子守恒来计算即可.
解答 解:(1)①As电子层数=周期数=4,最外层电子数=族序数=5,所以As位于第四周期,第ⅤA族,同主族,氢化物的稳定性从上到下逐渐减弱,所以AsH3的稳定性比NH3的稳定性弱,故答案为:第四周期,第ⅤA族;弱;
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷,据此得到反应的离子方程式为:2H3AsO3+3S2-+6H+=As2S3+6H2O,
故答案为:2H3AsO3+3S2-+6H+=As2S3+6H2O;
(2)①已知HCN为一元弱酸,则NaCN溶液是强碱弱酸盐,溶液的pH大于7,故答案为:>;
②在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3的方程式为:4H2O+2CN-+O2=2HCO3-+2NH3,故答案为:4H2O+2CN-+O2=2HCO3-+2NH3;
(3)①阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大,
故答案为:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大;
③在阳极上发生电极反应:4OH--4e-═2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA~H+~$\frac{1}{2}$H2,根据差值法,乳酸的浓度变化量是$\frac{145g/L-10g/L}{90g/mol}$=1.5mol/L,即生成HA的物质的量是1.5mol/L×0.4L=0.6mol,所以产生氢气是0.3mol即0.3mol×22.4L/mol=6.72L,故答案为:6.72.
点评 本题涉及元素在周期表中的分布、电解池和原电池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等.

 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | HF、HCl、HBr、HI 的热稳定性依次减弱 | |
| B. | HF、HCl、HBr、HI 的熔沸点逐渐升高 | |
| C. | 第ⅠA族元素和第ⅦA元素形成的化合物都属于离子化合物 | |
| D. | 因为H2O分子间存在氢键,所以热稳定性:H2O>H2S |
| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).
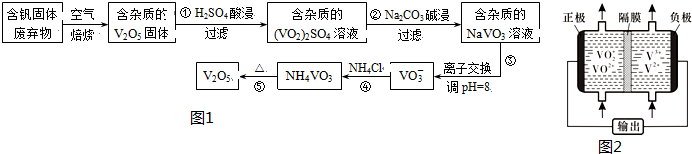
部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
| A. | 两者消耗NaOH的物质的量相同 | |
| B. | 中和HCl消耗NaOH的物质的量多 | |
| C. | 中和CH3COOH消耗NaOH的物质的量多 | |
| D. | 两者消耗NaOH的物质的量无法比较 |