题目内容
8.研究证明:CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

请回答下列问题:
(1)△H4=-128kJ•mol-1
(2)可以判断该反应已经达到平衡的是CE
A.v(CO2)=2v(C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不再改变
(3)曲线a表示的物质为H2(填化学式),判断依据由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度B.分离出H2OC.增加原催化剂的表面积D.增大压强
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势,并标明平衡时C2H4的体积分数数值.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,Ⅰ×2+Ⅱ+Ⅲ得到热化学方程式和对应焓变;
(2)反应是气体体积减小的放热反应,达到平衡状态的标志是正逆反应速率相同,各组分含量保持不变,分析选项中“变量不变”说明反应达到平衡状态;
(3)正反应放热反应,由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线;
(4)反应是放热反应,降低温度,平衡正向进行,反应前后气体体积减小,可采取的措施是增大压强平衡正向进行,分离出生成物,平衡正向进行等措施,改变条件使平衡状态正向进行;
(5)393K时体系中C2H4的体积分数随反应时间的变化趋势是,常温进料开始计时,反应不能进行,随温度升高,反应开始进行到393达到平衡状态,随温度升高,平衡逆向进行乙烯含量减小,据此画出图象变化;
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.01 kJ•mol-1
反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.52 kJ•mol-1
反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g)△H3=-5.46 kJ•mol-1
依据盖斯定律计算Ⅰ×2+Ⅱ+Ⅲ得到:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H4=-128KJ/mol,
故答案为:-128KJ/mol;
(2)2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H4=-128KJ/mol,可以判断该反应已经达到平衡的是
A.v(CO2)=2v(C2H4)表示的是正反应速率之比,不能说明正逆反应速率相同,故A错误;
B.反应前后气体质量和体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量变化,当混合气体的压强不再改变,说明反应达到平衡状态,故C正确;
D.平衡常数随温度变化,平衡常数K不再改变不能说明反应达到平衡状态,故D错误;
E.C2H4的体积分数不再改变是平衡的标志,故E正确;
故答案为:CE.
(3)正反应放热反应,由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线,
故答案为:H2,由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线;
(4)为提高CO2的平衡转化率,反应是放热反应,降低温度,平衡正向进行,反应前后气体体积减小,可采取的措施是增大压强或提高$\frac{n({H}_{2})}{n(C{O}_{2})}$比值,分离出生成物,平衡正向进行,二氧化碳转化率增大,催化剂改变化学反应速率不改变化学平衡;
故答案为:ABD;
(5)常温进料开始计时,反应不能进行,随温度升高,反应开始进行到393达到平衡状态,随温度升高,平衡逆向进行乙烯含量减小,据此画出图象变化,393K时体系中C2H4的体积分数随反应时间的变化趋势是增大后不变,图象为: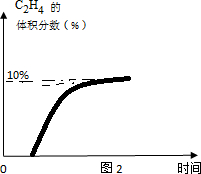 ,
,
故答案为:
点评 本题考查了热化学方程式书写方法,化学平衡影响因素,平衡标志分析,平衡常数,反应速率概念计算应用,图象的分析判断是解题关键,题目难度较大.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案| A. | 原子序数大小:X>Y | |
| B. | Xm+ 和Yn- 离子半径大小:r(Yn- )<r(Xm+) | |
| C. | 在周期表中X、Y在不同周期 | |
| D. | 在周期表中X、Y的族序数之差为:8-(m+n) |

| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时容器内c(Y)=0.76 mol/L | |
| B. | 830℃达平衡时,X的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数K=0.4 |
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,溶液中c(H+)不变 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
 .
.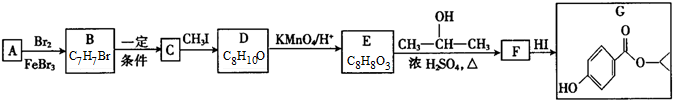
 G的官能团名称为羟基和酯基
G的官能团名称为羟基和酯基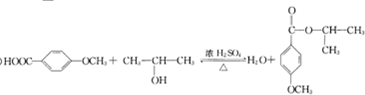
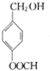
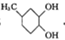

 .
.