题目内容
4.纯碱作为基本化工原料在国民经济中占有重要地位,联合制碱法制得优质纯碱的同时,还可得到副产品氯化铵,且达到充分利用原料的目的,工业流程及相关溶解度曲线如图,请回答: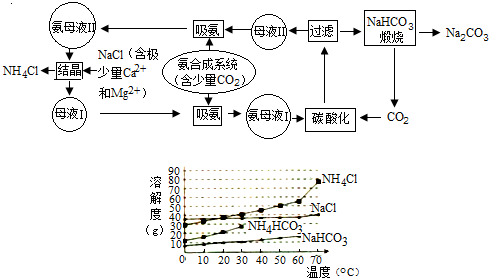
(1)母液Ⅰ的主要成分是NaCl,氨母液Ⅰ碳酸化时发生反应的化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓;氨母液Ⅰ保持在30℃~35℃下碳酸化,原因是防止碳酸氢铵分解
(2)在NaHCO3过滤后,将NH4Cl分离并使用剩余的母液回至制碱系统复用,是联碱法与氨碱法的主要区别,母液循环析出,除加入NaCl固体外,还应采取的措施是通入氨气
(3)不用其他试剂,检验NH4Cl是否纯净的方法及操作是取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净..
分析 以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法包括两个过程:第一个过程是将氨通入饱和食盐水而成氨盐水,再通入二氧化碳,发生反应:NH3+H2O+CO2=NH4HCO3.在溶液中就有了大量的钠离子、铵根离子、氯离子、碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,发生反应:NH4HCO3+NaCl=NH4Cl+NaHCO3↓.再利用碳酸氢钠不稳定性,受热容易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,得到纯碱,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用.
由流程图可知,母液Ⅰ由母液Ⅱ析出NH4Cl得到,故母液Ⅰ为NaCl溶液、母液Ⅱ为氯化铵和氯化钠的溶液.
解答 解:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法包括两个过程:第一个过程是将氨通入饱和食盐水而成氨盐水,再通入二氧化碳,发生反应:NH3+H2O+CO2=NH4HCO3.在溶液中就有了大量的钠离子、铵根离子、氯离子、碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,发生反应:NH4HCO3+NaCl=NH4Cl+NaHCO3↓.再利用碳酸氢钠不稳定性,受热容易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,得到纯碱,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用.
(1)由流程图可知,母液Ⅰ由母液Ⅱ析出NH4Cl得到,由上述分析可知,母液Ⅰ的主要成分是NaCl,氨母液Ⅰ碳酸化时发生反应的化学方程式为:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓,高于35℃NH4HCO3开始分解,氨母液Ⅰ保持在30℃~35℃下碳酸化,原因是:防止碳酸氢铵分解,
故答案为:NaCl;NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓;防止碳酸氢铵分解;
(2)在NaHCO3过滤后,将NH4Cl分离并使用剩余的母液回至制碱系统复用,是联碱法与氨碱法的主要区别,母液循环析出,除加入NaCl固体外,还应采取的措施是:通入氨气,
故答案为:通入氨气;
(3)从母液Ⅱ中析出的NH4Cl中可能含有NaCl,取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净,
故答案为:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净.
点评 本题考查侯德邦制碱法,掌握原理是解题的关键,是对学生综合能力的考查,题目难度中等.

| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2.8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 稀盐酸与稀氢氧化钠溶液的反应 |
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似.
| A. | 只有②③ | B. | 只有③④ | C. | ①②③④ | D. | 只有①③④ |
| A. | 只能是7 | B. | 只能是15 | C. | 是11或15 | D. | 是11或13 |
CH3CH2CH2COOH+
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H20
+H20| 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水中溶解性 | |
| 正丁酸 | 88 | 0.9587 | 163.5 | 溶 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |

实验步骤:
①如图1连接好装置,在三颈烧瓶中加入0.2mol异戊醇和0.1mol正丁酸、数滴浓硫酸、5mL苯和2~3片碎瓷片,充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和,用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g.
回答下列问题:
(1)图1中A仪器的名称是球形冷凝管或冷凝管,冷却水应从a(选择a或b)口进.
(2)在该实验中,三颈烧瓶的容积最适合的是B(填入正确选项前的字母).
A、50mL B、100mL C、200mL
(3)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是A(填入正确选项前的字母).
A、冷却后补加 B、立即补加 C、不需补加 D、重新配料
(4)加入过量异戊醇的目的是提高正丁酸的转化率,分离提纯过程中加入无水硫酸镁的目的是干燥.
(5)如图2,在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是c(填标号).
(6)本实验的产率是69.6%.(保留三位有效数字)
| A. | H2O2和CH3OH | B. | HNO2和HClO | C. | H2O和CH4 | D. | HCl和F2 |
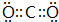 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是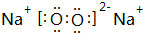 .
.

 +NaCl+3H2O.
+NaCl+3H2O. .
. .
.