4.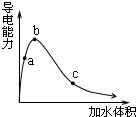 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )| A. | a、b、c三点醋酸的电离程度:c<a<b | |
| B. | a、b、c三点醋酸电离平衡常数:c<a<b | |
| C. | a、b、c三点溶液中的CH+:c<a<b | |
| D. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
3.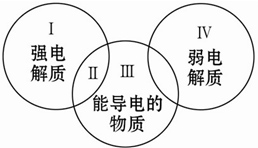 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )| A. | Ⅰ包含的物质有③④⑤⑧ | B. | Ⅱ中包含的物质是③ | ||
| C. | Ⅲ中包含的物质是①②③⑤⑥⑧ | D. | Ⅳ中包含的物质是⑥⑨⑩ |
19.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
| A. | 加热,将湿润的红色石蕊试纸放在管口 | |
| B. | 加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 | |
| C. | 加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 |
18.下列说法错误的是( )
| A. | 需要加热方能发生的反应不一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 吸热反应在一定的条件下也能发生 |
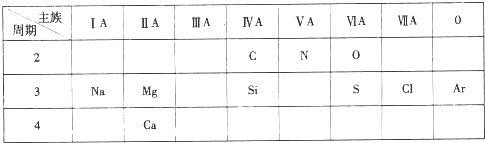
16.下表是短周期中部分元素的原子半径及主要化合价.请回答:
(1)Z单质与Y的最高价氧化物对应水化物的浓溶液加热反应可生成一种红棕色气体,则反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
15.下列离子方程式正确的是( )
0 167521 167529 167535 167539 167545 167547 167551 167557 167559 167565 167571 167575 167577 167581 167587 167589 167595 167599 167601 167605 167607 167611 167613 167615 167616 167617 167619 167620 167621 167623 167625 167629 167631 167635 167637 167641 167647 167649 167655 167659 167661 167665 167671 167677 167679 167685 167689 167691 167697 167701 167707 167715 203614
| A. | 向NaOH溶液中通入少量的SO2:SO2+OH-═HSO3- | |
| B. | 向氯水中通入少量的SO2:Cl2+SO2+2H2O═4H++2Cl-+SO42- | |
| C. | 将SO2通入到饱和的NaHCO3溶液中:2H++CO32-═H2O+CO2↑ | |
| D. | 将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
 .
. .
.
 ;
;