题目内容
16.下表是短周期中部分元素的原子半径及主要化合价.请回答:| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 W、R的化合价为+1,处于IA族,X最低最低价为-2,Y、Z最高价分别为+5、+4,则X、Y、Z分别处于ⅥA族、ⅤA族、ⅥA族,而X、Y、Z原子半径相近,故三种元素处于同周期,W原子半径小于X、Y、Z,故W只能处于第一周期,则W为H元素,R原子半径与X、Y、Z原子半径相差很大,R不能为同周期元素,则R处于第三周期,X、Y、Z处于第二周期,故R为Na,X为O,Y为N、Z为C,据此解答.
解答 解:W、R的化合价为+1,处于IA族,X最低最低价为-2,Y、Z最高价分别为+5、+4,则X、Y、Z分别处于ⅥA族、ⅤA族、ⅥA族,而X、Y、Z原子半径相近,故三种元素处于同周期,W原子半径小于X、Y、Z,故W只能处于第一周期,则W为H元素,R原子半径与X、Y、Z原子半径相差很大,R不能为同周期元素,则R处于第三周期,X、Y、Z处于第二周期,故R为Na,X为O,Y为N、Z为C.
(1)碳与浓硝酸反应生成二氧化氮、二氧化碳与水,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)实验室用氯化铵与氢氧化钙制在加热条件下制取NH3,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)Na2O2与H2O反应生成NaOH与氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)铁在高温下与H2O反应生成四氧化三铁与氢气,化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;
(5)由H、Na、O三种元素形成的离子化合物是强碱,该化合物为NaOH,与Al反应生成偏铝酸钠与氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对基础知识的理解掌握.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增效应大于热效应 |
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O | |
| B. | 向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
| A. | 一定条件下能发生加聚反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 该有机物能发生加成反应但不能发生催化氧化生成醛 | |
| D. | 1mol该有机物能与足量的金属钠反应放出0.5mol H2 |
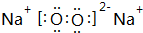 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.