题目内容
4.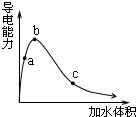 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )| A. | a、b、c三点醋酸的电离程度:c<a<b | |
| B. | a、b、c三点醋酸电离平衡常数:c<a<b | |
| C. | a、b、c三点溶液中的CH+:c<a<b | |
| D. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
分析 A.随水的增多,醋酸的电离程度在增大;
B.醋酸电离平衡常数只与温度有关;
C.导电能力越强,离子浓度越大,氢离子浓度越大;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同.
解答 解:A.随水的增多,醋酸的浓度减小,醋酸的电离程度增大,所以a、b、c三点醋酸的电离程度:a<b<c,故A错误;
B.醋酸电离平衡常数只与温度有关,温度不变,电离常数不变,则a、b、c三点醋酸电离平衡常数:a=b=c,故B错误;
C.导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液中的CH+:c<a<b,故C正确;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故D错误;
故选C.
点评 本题考查电解质的电离,题目难度中等,本题注意分析图象,把握弱电解质的电离特征,注意电离常数只与温度有关.

练习册系列答案
相关题目
15.已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能是( )
| A. | 431 kJ•mol-1 | B. | 946 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
12.V L含有(NH4)2SO4、NH4NO3的混合溶液,加入a molNaOH后,加热,恰好使NH3 全部逸出;又加入bmol BaCl2,刚好使SO42-完全沉淀.则原混合溶液中NH4NO3的物质的量浓度为( )
| A. | $\frac{a}{V}$mol/L | B. | $\frac{b}{V}$ mol/L | ||
| C. | $\frac{a-2b}{V}$ mol/L | D. | $\frac{a-b}{V}$mol/L |
19.试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
| A. | 加热,将湿润的红色石蕊试纸放在管口 | |
| B. | 加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 | |
| C. | 加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 |
16.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R原子完全转化为R2-时,含有电子的物质的量是( )
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w(m-n)}{m}$ mol | C. | w($\frac{m-n-2}{m}$) mol | D. | w($\frac{m-n+2}{m}$) mol |
13.下列离子方程式正确的是( )
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |