题目内容
15.下列离子方程式正确的是( )| A. | 向NaOH溶液中通入少量的SO2:SO2+OH-═HSO3- | |
| B. | 向氯水中通入少量的SO2:Cl2+SO2+2H2O═4H++2Cl-+SO42- | |
| C. | 将SO2通入到饱和的NaHCO3溶液中:2H++CO32-═H2O+CO2↑ | |
| D. | 将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
分析 A.二氧化硫少量反应生成亚硫酸钠和水;
B.向氯水中通入少量的SO2反应生成盐酸与硫酸;
C.二氧化硫与水反应生成亚硫酸,亚硫酸与碳酸氢钠反应生成亚硫酸钠和水、二氧化碳;
D.盐酸的酸性弱于亚硫酸,二氧化硫与氯化钡不反应.
解答 解:A.向NaOH溶液中通入少量的SO2,离子方程式:SO2+2OH-═H2O+SO32-,故A错误;
B.向氯水中通入少量的SO2,离子方程式:Cl2+SO2+2H2O═4H++2Cl-+SO42-,故B正确;
C.将SO2通入到饱和的NaHCO3溶液中,离子方程式:SO2+2HCO3-═H2O+CO2↑+SO32-,故C错误;
D.将SO2通入到BaCl2溶液中不发生反应,故D错误;
故选:B.
点评 本题考查了离子方程式的熟悉,明确发生反应是解题关键,注意碳酸氢根离子为多元弱酸根离子应保留化学式.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
5.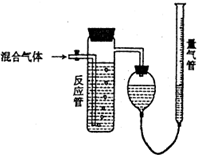 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
3.下列说法正确的是( )
| A. | 易溶于水的电解质一定是强电解质,难溶于水的电解质一定是弱电解质 | |
| B. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| C. | NaCl溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 氯化钠晶体不导电是由于氯化钠晶体中不存在自由移动的离子 |
10.在一定条件下,还原性顺序为Cl-<Br-<Fe2+<I-<SO2<H2S,由此判断下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | 2Fe3++H2S═2Fe2++S↓+2H+ | ||
| C. | I2+SO2+2H2O═2I-+SO42-+4H+ | D. | 2Br-+SO42-+4H+═Br2+SO2↑+2H2O |
4.研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法不正确的是( )
| A. | 羰基硫分子为非极性分子 | |
| B. | 羰基硫的结构式为:O=C=S | |
| C. | 羰基硫沸点比CO2高 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |
5.从柑桔中可炼制萜二烯(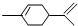 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )
 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )| A. | 分子中有10个C原子 | |
| B. | 与过量溴的CCl4 溶液反应后产物(右图)为: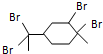 | |
| C. | 能发生加聚反应 | |
| D. | 常温下呈液态难溶于水 |
 ;②NH3的稳定性比PH3强(填写“强”或“弱”).
;②NH3的稳定性比PH3强(填写“强”或“弱”).
 ;
;