题目内容
20.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.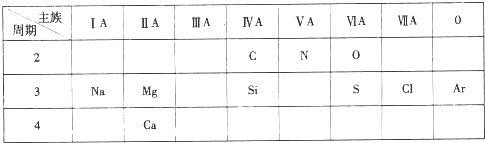
(1)金属性最强的元素是钙(填元素名称);
(2)Ar原子结构示意图为
 ;
;(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C和N中,原子半径较小的是N(填元素符号);
(5)“高钙牛奶”中的钙是指元素(填“元素”或“单质”);
(6)S和Cl中,气态氢化物较不稳定的是H2S<HCl.(填化学式);
(7)工业上固氮的反应方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
分析 (1)同周期自左而右金属性减弱,同主族自上而下金属性增强,结合金属活动顺序表判断Na与Ca的金属性强弱;
(2)Ar原子核外有18个电子层,由里到外各层电子数为2、8、8;
(3)非金属性越强,最高价氧化物对应水化物的酸性越强;
(4)同周期随原子序数增大,原子半径减小;
(5)Ca单质化学性质活泼,“高钙牛奶”中的钙是指Ca元素;
(6)非金属性越强,氢化物越稳定;
(7)工业上用氮气与氢气反应生成氨气进行氮的固定.
解答 解:(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故短周期中Na的金属性最强,在金属活动顺序表中Ca排在Na的前边,故Ca的金属性比Na强,故上述元素中Ca的金属性最强,故答案为:钙;
(2)Ar原子核外有18个电子层,由里到外各层电子数为2、8、8,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)同周期自左而右元素非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,故第三周期元素最高价含氧酸中HClO4的酸性最强,故答案为:HClO4;
(4)同周期随原子序数增大,原子半径减小,故原子半径C>N,故答案为:N;
(5)Ca单质化学性质活泼,“高钙牛奶”中的钙是指Ca元素,故答案为:元素;
(6)同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定,故氢化物稳定性H2S<HCl,故答案为:H2S<HCl;
(7)工业上用氮气与氢气反应生成氨气进行氮的固定,反应方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,重在对基础知识的巩固.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 为防止药品滴在桌面上,胶头滴管可伸入试管内部滴加液体 | |
| B. | 用量筒取13.37mL的稀硫酸 | |
| C. | 给试管内液体加热时,液体体积不超过试管容积的1/4 | |
| D. | 向酒精灯内添加酒精时,不能超过酒精灯容积的2/3 |
| A. | 5.6g铁与足量氯气完全反应时失去的电子数目为0.2NA | |
| B. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| C. | 标准状况下,2.24 L水中含有水分子0.1 NA | |
| D. | 2L1mol/L的盐酸中所含氯化氢分子数为2NA |
| A. | 向NaOH溶液中通入少量的SO2:SO2+OH-═HSO3- | |
| B. | 向氯水中通入少量的SO2:Cl2+SO2+2H2O═4H++2Cl-+SO42- | |
| C. | 将SO2通入到饱和的NaHCO3溶液中:2H++CO32-═H2O+CO2↑ | |
| D. | 将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
| A. | 垃圾是污染物,一定条件下还可能产生二次污染 | |
| B. | 堆肥法处理垃圾是最理想的垃圾处理方法 | |
| C. | 废旧金属、玻璃等不属于垃圾 | |
| D. | 没有绝对的垃圾,垃圾也可回收利用 |
| A. | 14C可用于文物的年代鉴定,14C与13C互为同素异形体 | |
| B. | 最外层电子数为2的元素一定是金属元素 | |
| C. | 过渡元素一定是金属元素 | |
| D. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1或11 |
| A. | 若P>K,则还原性cZP-<dWk- | |
| B. | 若m>n,则碱性 X(OH)m>Y(OH)n | |
| C. | 若半径aXm+>bYn+,则a<b | |
| D. | 若半径aXm+>bY n+,则X的单质一定能从含Yn+的盐溶液中置换出Y |
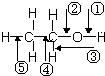
| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和浓氢溴酸共热时,键②和③断裂 | |
| D. | .在铜催化下和氧气反应时,键①和③断裂 |