8.下列反应所得溶液中,一定只含一种溶质的是( )
| A. | 向氯化铝溶液中加入过量的氨水 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向稀硝酸中加入铁粉 | |
| D. | 向硫酸酸化的MgSO4溶液中加入过量的Ba(OH)2溶液 |
7.下列有关能量的判断和表示方法正确的是( )
| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
6.铜锡合金,又称青铜,含锡量为$\frac{1}{4}$~$\frac{1}{7}$(质量比)的青铜被称作钟青铜.有一铜锡合金样品,可通过至少增加a g锡或至少减少b g铜恰好使其成为钟青铜,增加ag锡后的质量是减少bg铜后质量的2倍.则原铜锡合金样品中铜锡的质量之比为( )
| A. | 7:17 | B. | 3:2 | C. | 12:1 | D. | 7:1 |
5.将足量SO2气体通入下列各组溶液中,所含离子还能大量共存的是( )
| A. | Ba2+、Ca2+、Br-、Cl- | B. | CO32-、SO32-、K+、NH4+ | ||
| C. | Na+、NH4+、I-、HS- | D. | Na+、Ca2+、ClO-、NO3- |
4.下列物质的制备中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
3. 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-,.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
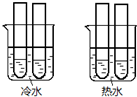
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式FeC2O4$\frac{\underline{\;高温\;}}{\;}$Fe+2CO2↑.
 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-,.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式FeC2O4$\frac{\underline{\;高温\;}}{\;}$Fe+2CO2↑.
1.铜锌合金俗称黄铜.下列不易鉴别黄铜与真金的方法是( )
| A. | 测密度 | B. | 测熔点 | C. | 灼烧 | D. | 看外观 |
20.分别含有下列各物质的废弃试剂,倒在同一废液缸中不会引起实验室污染或危险的一组是( )
| A. | 氨水和氢氧化钠 | B. | 硫酸铵和氯化钡 | C. | 硝酸亚铁和盐酸 | D. | 电石和盐酸 |
19.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )
0 167493 167501 167507 167511 167517 167519 167523 167529 167531 167537 167543 167547 167549 167553 167559 167561 167567 167571 167573 167577 167579 167583 167585 167587 167588 167589 167591 167592 167593 167595 167597 167601 167603 167607 167609 167613 167619 167621 167627 167631 167633 167637 167643 167649 167651 167657 167661 167663 167669 167673 167679 167687 203614
| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.