题目内容
7.下列有关能量的判断和表示方法正确的是( )| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
分析 A、依据能量守恒分析判断,能量越高越活泼;
B、固体硫变为蒸气需要吸收热量;
C、酸碱中和反应的中和热是强酸强碱的稀溶液反应生成1mol水放出的热量,醋酸电离吸热;
D、热化学方程式必须标注物质的聚集状态,反应热必须符合化学方程式系数关系.
解答 解:A、石墨变化为金刚石过程是吸热反应,金刚石能量高,石墨比金刚石稳定,故A正确;
B、等质量的硫蒸气和硫固体分别完全燃烧,固体硫变为蒸气需要吸收热量,前者放出热量更多,故B错误;
C、含1molCH3COOH的溶液与含1molNaOH的溶液混合,醋酸为弱酸,溶于水电离需要吸热,放出热量小于57.3 kJ,故C错误;
D、2gH2物质的量为1mol,此反应为放热反应,△H<0,故氢气燃烧的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,故D错误;
故选A.
点评 本题考查了中和热的概念应用,物质的能量越高越活泼,热化学方程式的书写原则,盖斯定律的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 稀有气体元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
15.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题
(1)元素B的元素符号是:C化合物丙的电子式为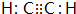 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.
(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: .
.
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
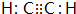 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
16.下列有关化学概念或原理的论述中正确的是( )
| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)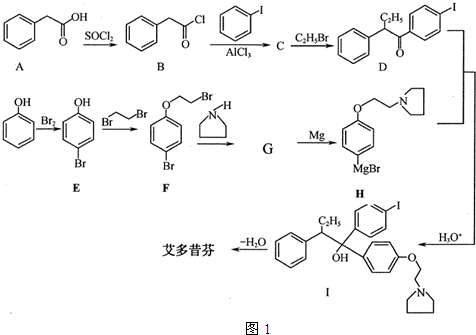
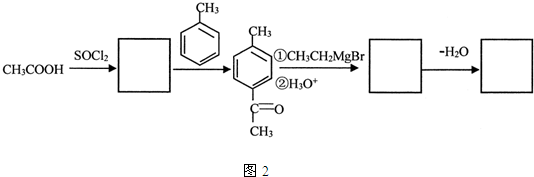
 ; 艾多昔芬
; 艾多昔芬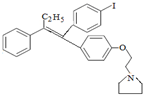 .
.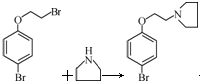 +HBr
+HBr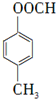 .
.