题目内容
6.铜锡合金,又称青铜,含锡量为$\frac{1}{4}$~$\frac{1}{7}$(质量比)的青铜被称作钟青铜.有一铜锡合金样品,可通过至少增加a g锡或至少减少b g铜恰好使其成为钟青铜,增加ag锡后的质量是减少bg铜后质量的2倍.则原铜锡合金样品中铜锡的质量之比为( )| A. | 7:17 | B. | 3:2 | C. | 12:1 | D. | 7:1 |
分析 设原青铜中铜质量为x,锡质量为y,由题意可知①(x+y+a)=2(x+y-b),②$\frac{y+a}{x+y+a}$=$\frac{1}{7}$,③$\frac{y}{x+y-b}$=$\frac{1}{7}$,联立计算出原铜锡合金样品中铜锡的质量之比.
解答 解:设原青铜中铜质量为x,锡质量为y,依据题意有:①(x+y+a)=2(x+y-b),②$\frac{y+a}{x+y+a}$=$\frac{1}{7}$,③$\frac{y}{x+y-b}$=$\frac{1}{7}$,
根据②可得:⑤x+y+a=7(y+a),
根据③可得:⑥x+y-b=7y,
将⑤⑥带人①可得:y=7a,
将y=7a带入②可得:x=12a,
所以原铜锡合金样品中铜锡的质量之比为12a:a=12:1,
故选C.
点评 本题考查了混合物反应计算,题目难度中等,明确合金中含锡量$\frac{1}{4}$~$\frac{1}{7}$(质量比)的含义及至少加入铜或锡的质量与含锡量的对应关系为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
14.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且简单离子Ym-与Zn+具有相同的核外电子排布.下列化合物中同时存在非极性键和离子键的是( )
| A. | Z2Y2 | B. | X2Y2 | C. | Z2Y | D. | ZYX |
1.铜锌合金俗称黄铜.下列不易鉴别黄铜与真金的方法是( )
| A. | 测密度 | B. | 测熔点 | C. | 灼烧 | D. | 看外观 |
11.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):关于该固体混合物,下列说法正确的是( )


| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
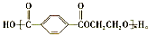 .
.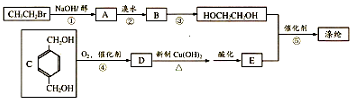
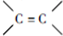 ,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;
,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;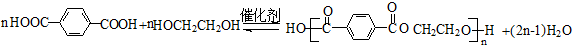 ;
;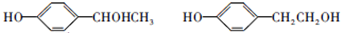 ;
;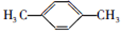 ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
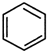 +(CH3CO)2O→
+(CH3CO)2O→ +CH3COOH
+CH3COOH ; B
; B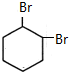
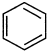 直接制取
直接制取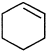 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.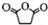 +
+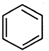 →
→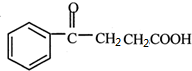 .
.