题目内容
19.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
分析 A.分子式相同结构不同的化合物互为同分异构体;
B.同种元素形成的不同单质互为同素异形体;
C.同位素研究的对象是原子;
D.1个氧原子中有8个电子.
解答 解:A.${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2为同种物质,故A错误;
B.${\;}_{8}^{18}$O2与O3都是氧元素的单质,互为同素异形体,故B正确;
C.${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2是分子,不是原子,故C错误;
D.1mol ${\;}_{8}^{18}$O2分子中含有16mol电子,故D错误.
故选B.
点评 本题考查化学“五同”比较,难度较小,清楚概念的内涵与外延.注意.${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2为同种物质.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
10.化学与生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 地沟油的主要成分是油脂,其组成与汽油、煤油相同 | |
| C. | 合成纤维、人造纤维及光导纤维都属于有机高分子材料 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
7.国际理论与应用化学联合会(IUPAC)在2012年5月30日宣布第116号元素的元素符号是Lv,此前暂用名为Uuh.下列有关叙述中错误的是( )
| A. | Lv位于周期表中第七周期第ⅥA族 | B. | Lv原子的次外层电子数为18 | ||
| C. | Lv为非金属元素 | D. | Lv为放射性元素 |
14.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且简单离子Ym-与Zn+具有相同的核外电子排布.下列化合物中同时存在非极性键和离子键的是( )
| A. | Z2Y2 | B. | X2Y2 | C. | Z2Y | D. | ZYX |
4.下列物质的制备中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
11.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):关于该固体混合物,下列说法正确的是( )


| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
9.往Ba(C1O)2溶液中通入足量SO2气体后,溶液中的溶质是( )
| A. | H2SO4 | B. | HCl | C. | HClO | D. | Ba(HSO3)2 |

 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.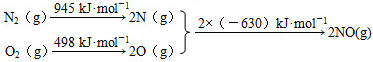 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.