题目内容
2. 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.填空:
(1)写出Cl原子的核外电子排布式1s22s22p63s23p5,NaCl的熔点比KCl高 (选填“高”或“低”).
(2)指出钾长石中存在的化学键类型离子键和共价键.
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是Na.
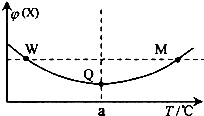
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得数据曲线如图.
①分析数据可知,Q<0(选填“>”或“<”).
②950℃时,欲提高钾的熔出速率可以采取的措施是bd(填序号).
a.延长反应时间
b.充分搅拌
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
③要使钾元素的熔出率和熔出速率都达到最大,反应温度应为950℃.
(5)工业上常用KCl冶炼金属钾.反应方程式为:Na(l)+KCl(l)?NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:将气态钾分离出来,降低了产物的浓度,平衡正向移动.
分析 (1)氯原子的核外电子总数为17,根据构造原理写出其核外电子排布式;离子半径越小,离子的熔点越低;
(2)钾长石(KAlSi3O8)中即含有金属与非金属元素形成的离子键,也含有非金属元素之间形成的共价键;
(3)位于同周期元素有Na、Al、Si、Cl,元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应为Na;
(4)①由图象中曲线变化可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,据此判断;
②该转化过程没有气体参与,应使反应物充分接触提供反应速率;
③根据图象曲线变化可知,温度越高,钾元素的熔出率和熔出速率都都增大;
(5)K为气态,将钾分离出来,降低了产物的浓度,平衡正向移动.
解答 解:(1)Cl所含质子数为17,原子核外电子数为17,根据能量最低原则、泡利不相容原理和洪特规则核外电子排布式为1s22s22p63s23p5;
离子晶体的晶格能大小取决于离子半径的电荷的因素,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,则熔点大小为:KCl<NaCl
故答案为:1s22s22p63s23p5;高;
(2)根据质量守恒,将斜长石用氧化物的形式表示为K2O•Al2O3•6SiO2,钾长石(KAlSi3O8)中即含有金属与非金属元素形成的离子键,也含有非金属元素之间形成的共价键,
故答案为:离子键和共价键;
(3)上述反应涉及的位于同周期元素有Na、Al、Si、Cl,元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应为Na,故答案为:Na;
(4)①由图象曲线数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应,Q<0,
故答案为:<;
②a.延长反应时间,不能提高反应速率,故a错误;
b.充分搅拌,反应物充分接触,反应速率加快,故b正确;
c.该反应体系没有气体参加,增大反应体系的压强,不能提高反应速率,故c错误;
d.将钾长石粉粹成更小的颗粒,增大反应物的接触面积,反应速率加快,故d正确;
故答案为:bd;
③根据图象可知,温度为950℃时熔出率和熔出速率都最高,故答案为:950℃;
(5)根据反应方程式可知,K为气态,将钾分离出来,降低了产物的浓度,平衡正向移动,故答案为:将气态钾分离出来,降低了产物的浓度,平衡正向移动.
点评 本题考查了化学平衡及其影响、化学键类型、原子核外电子排布等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握化学平衡及其影响因素.

 同步奥数系列答案
同步奥数系列答案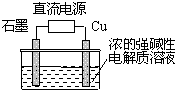 Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 铜电极发生氧化反应 | |
| B. | 铜电极接直流电源的负极 | |
| C. | 石墨电极上产生氢气 | |
| D. | 每生成1molCu2O时,就有2mol电子转移 |
| A. | 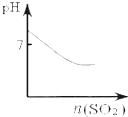 可表示将SO2气体通入氯水时pH的变化 | |
| B. |  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液 | |
| C. | 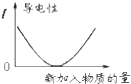 表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 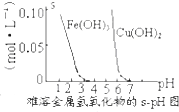 根据图,除去CuSO4溶液中Fe3+,可加氨水调节pH=4 |
| A. | Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能 | |
| B. | 铝的原子半径比镁小 | |
| C. | 镁与浓硫酸反应,铝与冷的浓硫酸不反应 | |
| D. | 铝的金属光泽不如镁显著 |
| A. | C4H8 | B. | C4H9Cl | C. | C4H10O | D. | C4H8O2 |
| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为Z<X<W | |
| C. | 室温下,含Y元素的盐形成的水溶液其pH<7 | |
| D. | Z元素的单质和氧化物均既能与NaOH溶液反应也能与某种酸反应 |
 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )| A. | M点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | W,M两点Y的正反应速率相等 |
| A. | Na3PO4 | B. | Na4P2O7 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |