题目内容
20.分别含有下列各物质的废弃试剂,倒在同一废液缸中不会引起实验室污染或危险的一组是( )| A. | 氨水和氢氧化钠 | B. | 硫酸铵和氯化钡 | C. | 硝酸亚铁和盐酸 | D. | 电石和盐酸 |
分析 两种溶液能倒在同一废液缸中,不能生成有毒有害物质,结合选项中物质的性质来解答.
解答 解:A.氨水和氢氧化钠混合能使氨气挥发,故A错误;
B.硫酸铵和氯化钡反应生成硫酸钡和氯化铵,能倒在一起,故B正确;
C.硝酸亚铁和盐酸反应生成NO,NO为空气污染物,则不能倒在一起,故C错误;
D.电石中的杂质和盐酸反应生成硫化氢,污染空气,故D错误.
故选B.
点评 本题考查环境保护问题,把握物质的性质及常见的空气污染物为解答本题的关键,注重化学与生活、环境的联系,题目难度不大.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 放热反应一定能自发的进行 | |
| B. | SO2能使品红溶液和溴水褪色,说明SO2具有漂白性 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl(s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
11.下列说法正确的是( )
| A. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
8.根据热化学方程式,正确的是( )
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-Q1 kJ•mol-1
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H2=-Q2 kJ•mol-1.
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-Q1 kJ•mol-1
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H2=-Q2 kJ•mol-1.
| A. | Q1>Q2 | B. | △H1>△H2 | C. | Q1=Q2 | D. | △H1<△H2 |
15.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题
(1)元素B的元素符号是:C化合物丙的电子式为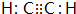 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.
(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: .
.
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
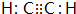 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
5.将足量SO2气体通入下列各组溶液中,所含离子还能大量共存的是( )
| A. | Ba2+、Ca2+、Br-、Cl- | B. | CO32-、SO32-、K+、NH4+ | ||
| C. | Na+、NH4+、I-、HS- | D. | Na+、Ca2+、ClO-、NO3- |
9.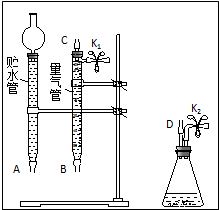 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目: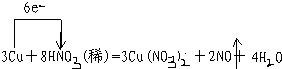 .
.
②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:
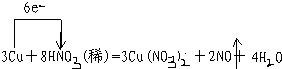 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
10.某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+.以下离子方程式肯定不符合反应事实的是( )
| A. | Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O | |
| B. | Mg2++2HCO3-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O | |
| D. | Ca2++CO32-→CaCO3↓ |

 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)