题目内容
8.下列反应所得溶液中,一定只含一种溶质的是( )| A. | 向氯化铝溶液中加入过量的氨水 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向稀硝酸中加入铁粉 | |
| D. | 向硫酸酸化的MgSO4溶液中加入过量的Ba(OH)2溶液 |
分析 A、氢氧化铝不溶于氨水;
B、向稀盐酸中滴入少量的NaAlO2溶液,溶液中存在NaCl、AlCl3等溶质;
C、向稀硝酸中加入铁粉可生成Fe(NO3)2、Fe(NO3)3等;
D、向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液,反应生成Mg(OH)2和BaSO4沉淀.
解答 解:A、氨水是弱碱,不能溶解氢氧化铝,氯化铝溶液加入过量氨水的反应方程式为:AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,反应所得的溶液中溶质为过量的一水合氨和产物NH4Cl,故A错误;
B、向稀盐酸中滴入少量的NaAlO2溶液,溶液中存在NaCl、AlCl3等溶质,故B错误;
C、向稀硝酸中加入铁粉,如Fe过量,溶液中可能存在Fe(NO3)2、Fe(NO3)3等溶质,如Fe不足,则存在HNO3、Fe(NO3)3,故C错误;
D、向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液,反应生成Mg(OH)2和BaSO4沉淀,最后溶液中只有过量的Ba(OH)2,只有一种溶质,故D正确,故选D.
点评 本题考查元素化合物知识,题目难度不大,本题注意把握常见元素化合物的性质.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
19.镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )
| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
3. 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-,.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
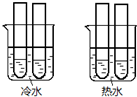
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式FeC2O4$\frac{\underline{\;高温\;}}{\;}$Fe+2CO2↑.
 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-,.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式FeC2O4$\frac{\underline{\;高温\;}}{\;}$Fe+2CO2↑.
20.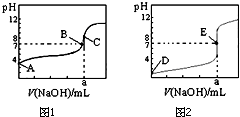 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )| A. | 图1是滴定盐酸的曲线 | |
| B. | E点时溶液中离子浓度为c(Na+ )=c(A- ) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)>V(HA) | |
| D. | 当0mL<V(NaOH)<20.00mL时,溶液中一定是c(A-)>c(Na+ )>c(H+ )>c(OH- ) |
17.下列说法正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
18.含不溶杂质的NaN03样品,加入一定量蒸馏水使其充分溶解,情况如表:
NaNO3溶解度(g/100g水)如表:
(1)实验中加入的水为300g;
(2)原样品中NaN03为372g.
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
| 温度(℃) | 10 | 40 | 75 |
| 溶解度 | 81 | 104 | 150 |
(2)原样品中NaN03为372g.
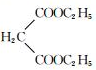 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$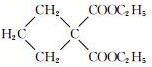 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
$→_{ii.H+/△}^{i.H_{2}O,OH-}$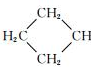 -COOH
-COOH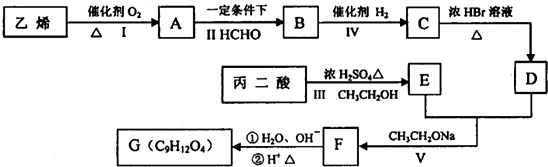
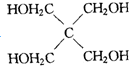 G
G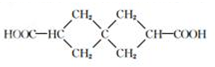
 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验: