6.下列说法正确的是( )
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 水力发电是将化学能转化为电能的过程 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 生铁、不锈钢、青铜都属于合金 |
4.金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
(3)求该混合物中Be2C与CaC2的物质的量之比.
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 6.2 | 9.3 | 15.5 | 21.7 |
| 水(mL) | 18 | 18 | 18 | 18 |
| 气体(L,标准状况) | 3.36 | 5.04 | 8.4左右 | 8.4左右 |
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
3.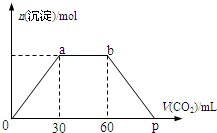 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | 横坐标轴上p点的值为90 | |
| C. | b点时溶质为NaHCO3 | |
| D. | ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3- |
2.下列叙述正确的是( )
| A. | 含4NA个离子的固体Na2O溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 | |
| B. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2一+O2+2H2O═2S↓+4OH- | |
| C. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3 | |
| D. | 滴加KSCN显红色的溶液中存在:NH4+、K+、C1-、I- |
1.某一不饱和酯类化合物(如图)在药物、涂料等领域应用广泛,下列有关说法不正确的是( )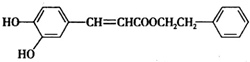
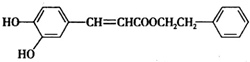
| A. | 能使KMnO4溶液褪色 | |
| B. | 1mol的该化合物和足量的钠反应生成1molH2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1mol该化合物最多与2molNaOH反应 |
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断正确的是( )
| A. | 原子半径由小到大的顺序:r(C)<r(D)<r(E) | |
| B. | 元素D、E分别与A形成的化合物的热稳定性:E>D | |
| C. | 元素D的最高价氧化物对应水化物的酸性比E的强 | |
| D. | 元素B分别与A、C形成的化合物中化学键的类型不同 |
19.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是( )
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
18.下列说法正确的是( )
| A. | 青铜、碳素钢和石英都是合金 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 乙醇与乙醛互为同分异构体,都能发生银镜反应 | |
| D. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
17.X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如表:
(1)W位于元素周期表第三周期第ⅢA族;W的简单离子半径比Z的简单离子半径小(填“大’’或“小”).
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
0 167464 167472 167478 167482 167488 167490 167494 167500 167502 167508 167514 167518 167520 167524 167530 167532 167538 167542 167544 167548 167550 167554 167556 167558 167559 167560 167562 167563 167564 167566 167568 167572 167574 167578 167580 167584 167590 167592 167598 167602 167604 167608 167614 167620 167622 167628 167632 167634 167640 167644 167650 167658 203614
| 元素 | 相关信息 |
| X | 元素周期表中核电荷数最小的元素 |
| y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.