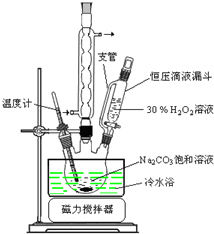
题目内容
3.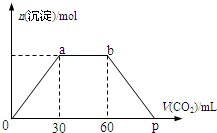 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | 横坐标轴上p点的值为90 | |
| C. | b点时溶质为NaHCO3 | |
| D. | ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3- |
分析 向NaOH和Ba(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钡反应生成碳酸钡沉淀,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠,当氢氧化钠完全反应后,继续通入二氧化碳,二氧化碳和碳酸钠、水反应生成碳酸氢钠,当碳酸钠反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡.
A.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-分析解答;
B.根据OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-分析解答;
C.ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-,据此回答;
D.a,b段反应分二阶段,先是二氧化碳和氢氧化钠反应生成碳酸钠,后是二氧化碳和碳酸钠、水反应生成碳酸氢钠.
解答 解:A.OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳、ab段:2OH-+CO2═CO32-+H2O、ab段消耗(60-30)mL的二氧化碳;bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,由Oa段和ac段的反应原理可知,消耗二氧化碳的量Ba(OH)2和NaOH的物质的量相等,所以原混合溶液中Ba(OH)2和NaOH的物质的量之比为30:(60-30)=1:1,故A错误;
B.OA段:Ba2++2OH-+CO2═BaCO3↓+H2O,消耗30mL的二氧化碳,bp段:最后是BaCO3+CO2+H2O═Ba2++2HCO3-,需消耗30mL的二氧化碳,所以P点为90mL,故B正确;
C.ab段:2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2=2HCO3-,所以b点溶液中溶质为NaHCO3,故C正确;
D.a、b段,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,CO2+2OH-=CO32-+H2O,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,CO32-+H2O+CO2=2HCO3-,故D正确;
故选A.
点评 本题考查物质之间的反应,明确物质的性质、及反应先后顺序是解本题关键,题目难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 羟基可以电离成H+和O2- | B. | 1mol羟基共有9mol电子 | ||
| C. | 与氢氧根离子是类别异构 | D. | 羟基只存在于分子晶体中 |
| A. | 原子半径由小到大的顺序为:rW<rZ<rY | |
| B. | 简单离子氢化物的热稳定性Z>Y | |
| C. | X2W的沸点高于X2Z | |
| D. | 只含X、Y、W三种元素的化合物,不可能是离子化合物 |
| A. | 青铜、碳素钢和石英都是合金 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 乙醇与乙醛互为同分异构体,都能发生银镜反应 | |
| D. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
| A. | 向AgCl悬浊液中加入KBr溶液:Ag++Br-=AgBr | |
| B. | 用铁棒作阴极、碳棒作阳极电解饱和氯化镁溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O | |
| D. | 在强碱性溶液中NaClO与Fe(OH)3生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO43-+3C1-+5H2O |
| A. | 化学反应速率可用某时刻生成物的物质的量来表示 | |
| B. | 在同一反应中,用反应物或生成物表示的化学反应速率的值是相对的 | |
| C. | 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 | |
| D. | 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |
| A. | 氧原子能量最高的电子的电子云图: | |
| B. | 35Cl与37Cl互为同素异形体 | |
| C. | CH4分子的比例模型: | |
| D. | 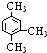 的命名:1,3,4-三甲苯 的命名:1,3,4-三甲苯 |
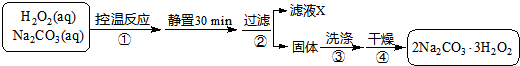 图1
图1