题目内容
19.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是( )| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
分析 R的气态氢化物的水溶液呈碱性,则R是氮元素,X是同周期中原子半径最大的元素是钠元素,Y的单质是一种常见的半导体材料是硅,Y与Z的原子序数相差3,Z是氯元素,由此分析解答.
解答 解:A、Z、R、Y的最外层电子数分别为:7、5、4,所以最外层电子数:Z>R>Y,故A正确;
B、非金属性越强氢化物越稳定,非金属性Cl>Si,所以气态氢化物的稳定性:X>Y,故B错误;
C、氮的氧化物是共价化合物,故C错误;
D、X最高价氧化物对应的水化物是氢氧化钠而Y最高价氧化物对应的水化物硅酸,可以发生酸碱中和反应,故D正确;
故选AD.
点评 本题考查原子结构与元素周期律,侧重于位置结构性质关系,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
10.分子式为C4H8O2,且含有-COO-结构的同分异构体有几种( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
14.如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序为Na>Cl>F (用元素符号表示).
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
4.金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
(3)求该混合物中Be2C与CaC2的物质的量之比.
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 6.2 | 9.3 | 15.5 | 21.7 |
| 水(mL) | 18 | 18 | 18 | 18 |
| 气体(L,标准状况) | 3.36 | 5.04 | 8.4左右 | 8.4左右 |
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
11.在研究物质变化时,人们可以从不同的角度,不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
| A. | 化学反应的实质是旧键的断裂和新化学键生成 | |
| B. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| C. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 | |
| D. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |

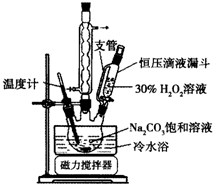 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.