题目内容
2.下列叙述正确的是( )| A. | 含4NA个离子的固体Na2O溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 | |
| B. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2一+O2+2H2O═2S↓+4OH- | |
| C. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3 | |
| D. | 滴加KSCN显红色的溶液中存在:NH4+、K+、C1-、I- |
分析 A.1mol氧化钠含有3mol离子,结合n=计算氧化钠的物质的量,氧化钠溶于水生成NaOH,根据钠离子守恒结合c=计算;
B.硫离子被氧气氧化生成硫,结合电荷守恒可知,有氢氧根离子守恒,配平书写离子方程式判断;
C.碳酸钠、碳酸氢钠均与氢氧化钙反应得到碳酸钙沉淀;
D.滴加KSCN显红色的溶液中存在铁离子,铁离子具有强氧化性,可以氧化I-.
解答 解:A.1mol氧化钠含有3mol离子,氧化钠的物质的量×=mol,氧化钠溶于水生成NaOH,根据钠离子守恒,溶液中钠离子物质的量为mol×2=mol,故钠离子浓度为=mol/L,故A错误;
B.硫离子被氧气氧化生成硫,结合电荷守恒可知,有氢氧根离子守恒,配平后离子方程式为:2S2-+O2+2H2O═2S↓+4OH-,故B正确;
C.碳酸钠、碳酸氢钠均与氢氧化钙反应得到碳酸钙沉淀,无法鉴别,故C错误;
D.滴加KSCN显红色的溶液中存在铁离子,铁离子具有强氧化性,可以氧化I-,不能与碘离子大量共存,故D错误,
故选B.
点评 本题考查物质的量浓度计算、离子方程式、物质检验、离子共存,是对学生综合知识的考查,难度中等.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
8.O、O是氧元素的两种原子,下列说法正确的是( )
| A. | O和O的物理性质相同、化学性质不相同 | |
| B. | 通过化学反应可实现O与O之间相互转化 | |
| C. | O和O的原子核外电子排布的方式不相同 | |
| D. | O和O能形成三种化学性质相同的氧分子 |
10.下列反应的离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe2++Fe3++4H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 溶液中FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+Br2 |
17.X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如表:
(1)W位于元素周期表第三周期第ⅢA族;W的简单离子半径比Z的简单离子半径小(填“大’’或“小”).
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH33Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| 元素 | 相关信息 |
| X | 元素周期表中核电荷数最小的元素 |
| y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH33Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
7.化学与生产、生活密切相关,下列说法错误的是( )
| A. | 雾霾可能是许多组小液体和固体微粒分散到空气中形成的一种气溶胶 | |
| B. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| C. | 含磷合成洗涤剂易被细菌分解,故不会导致水体污染 | |
| D. | 大量使用风能、太阳能、符合“低碳”概念 |
14.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物.而辛是由C元素形成的单质.已知;甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol•L-1丁溶液的pH为13,则下列说法正确的是( )
| A. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| B. | C的单质在点燃条件分别与A、B、D的单质化合,所得化合物均存在共价键 | |
| C. | 四种元素的单质中,熔沸点最高的是D的单质 | |
| D. | C和D所形成离子的电子层结构一定相同 |
11.常温下,有下列4中溶液,下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1 mol/L-1 CH3COOH溶液 | pH=3 CH3COOH 溶液 | 0.1 mol/L-1 NaOH溶液 | pH=11 NaOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ①稀释到原来的100倍后,pH与②相同 | |
| C. | ①与③混合,若溶液pH=7,则两溶液的体积:③>① | |
| D. | ②与④混合,若溶液pH=7,则两溶液的体积:④>② |
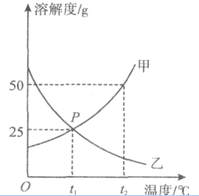 如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.